
LE TISSU CARTILAGINEUX
I) le tissu cartilagineux mature :
1) les cellules :
A la différence du tissu osseux mature, le tissu cartilagineux mature présente un faible taux de renouvellement. Il ne contient qu’un seul type cellulaire : les chondrocytes.
Les chondrocytes sont des cellules qui chez l’adulte ne se divisent pas (cellules post-mitotiques). Elles sont arrondies avec de courts prolongements et sont entourées de matrice cartilagineuse rigide mais non calcifiée. Cette matrice forme des logettes anatomiques sans parois propres, les chondroplastes. Chaque chondroplaste contient un ou plusieurs chondrocytes. Les chondrocytes synthétisent la matrice cartilagineuse et interagissent avec elle via l’expression de récepteurs membranaires. Il s’agit en particulier de la molécule CD44 dont le ligand est l’acide hyaluronique et d’Intégrines qui interagissent avec de nombreuses molécules matricielles. Les chondrocytes présentent les caractéristiques morphologiques de cellules à activité sécrétrice: le REG et l’appareil de golgi sont développés.
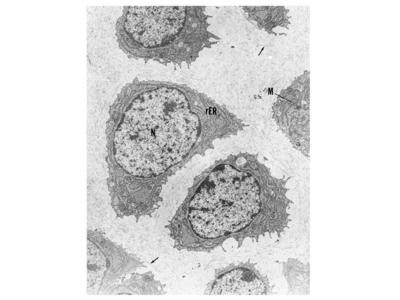
Cette activité de synthèse protéique correspond essentiellement à la sécrétion de l’ensemble des protéines de la matrice cartilagineuse. Toutefois, les chondrocytes synthétisent également à bas bruit des molécules induisant la résorption de la matrice cartilagineuse. Parmi ces molécules, citons les métalloprotéases ("matrix metalloprotéases : MMP"). Chez l’adulte, cette activité de résorption est très faible en situation normale. Par ailleurs, les chondrocytes renferment des grains de glycogène et des vacuoles lipidiques dont les fonctions sont encore mal connues.
2) la matrice : Chez l'adulte, on distingue 3 types de tissu cartilagineux qui se distinguent essentiellement par la composition de leur matrice.
Pour mémoire : Les chondrocytes sont des cellules post-mitotiques in vivo mais capables de proliférer in vitro après avoir été prélevées au niveau d'un cartilage mature. En conditions de culture standard, les chondrocytes adhèrent au plastique des boites de cultures et se dé-différencient rapidement en fibroblastes. Pour permettre leur prolifération et le maintien d’un phénotype chondrocytaire, on doit cultiver les chondrocytes dans un gel contenant des facteurs de croissance et des molécules de la matrice cartilagineuse. Les chondrocytes ainsi générés peuvent être utilisés à des fins de recherche ou être réimplantés au sein de cartilages lésés. La greffe autologue de chondrocytes est actuellement utilisée pour le traitement de lésions cartilagineuse du sujet jeune. On a en effet observé que le potentiel chondrogènique des chondrocytes est étroitement dépendant de l’age du donneur (plus faible à partir de 40 ans, très faible à partir de 70 ans). Par ailleurs, on considère que les chondrocytes forment une population hétérogène quant à leur capacité à proliférer in vitro. Au sein d’un tissu cartilagineux articulaire, on observera ces différences fonctionnelles lorsqu’on compare chondrocytes superficiels et chondrocytes profonds.
a) le tissu cartilagineux hyalin : c'est le plus répandu et il est localisé au niveau des cartilages articulaires, des cartilages trachéo-bronchiques ainsi qu'au niveau des cartilages intercostaux. La matrice y contient différents types de collagène mais majoritairement du collagène type II (80 à 90% du contenu en collagène de la matrice du tissu cartilagineux hyalin). Le collagène type II n’est pas strictement spécifique des tissus cartilagineux. Quelque soit sa localisation, le collagène type II s'organise en microfibrilles et non pas en fibres et en faisceaux comme le collagène I. De ce fait, il n’est pas observable en microscopie optique à l'aide des colorations standards permettant la visualisation des faisceaux de collagène (trichrome de Masson, Jaune Safran). Cette caractéristique associée à l’absence de vaisseaux et de nerfs confère un aspect amorphe à la matrice.
Par ailleurs, le turn-over de ce réseau de collagène est quasiment nul dans le tissu cartilagineux hyalin mature (donc faible capacité de réparation tissulaire). Comme l'ensemble des cartilages, la matrice du tissu cartilagineux hyalin contient essentiellement de l'eau (70 à 80% du poids hydraté). Cette grande capacité de rétention de l'eau est liée à la présence abondante d’aggrégats de protéoglycanes contenant des glycosaminoglycanes (GAG) sulfatés, qui sont riches en radicaux acides hydrophiles.
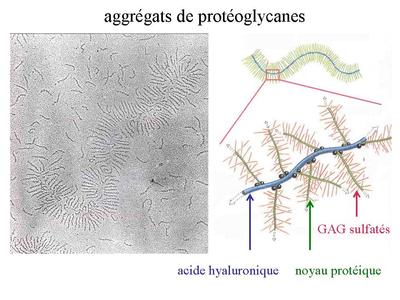
Pour mémoire : Ces GAG forment des protéoglycanes sulfatés dont le principal est l'aggrécan et les molécules d'aggrécan s'assemblent elles-mêmes à des molécules d'acides hyaluronique pour former un maillage d'aggrégats de protéolycanes (Cf cours tissu conjonctif) à forte capacité d'absorption hydrique. Par ailleurs, le métabolisme des protéoglycanes au sein du cartilage articulaire dépend des facteurs biomécaniques auxquels est soumise l'articulation. Lors d'une immobilisation complète, on observera une diminution de leur synthèse avec un amincissement cartilagineux associé à une fuite d'eau tissulaire. Par ailleurs, la fonction de rétention d’eau exercée par les protéoglycanes est responsable la déformabilité et de la résistance du tissu cartilagineux hyalin. Ainsi, lorsqu'une forte pression est exercée sur un cartilage articulaire par exemple, une partie de l'eau est expulsée mais l'augmentation de la pression osmotique induit un afflux d'eau qui rétablit la concentration en eau et une forte pression hydrostatique.
Outre la rétention de l'eau, le rôle des aggrégats de protéoglycanes de la matrice cartilagineuse est de permettre la diffusion et/ou la fixation de nombreuses molécules (facteurs de croissance, cytokines, métabolites, nutriments, hormones...) nécessaires à la fonction des chondrocytes. Dans le cas des cartilages articulaires, le tissu cartilagineux est nourri par des molécules diffusant à partir du liquide synovial et du tissu osseux sous-jacent (os sous-chonral). Dans les autres types de cartilages hyalin comme par exemple le cartilage trachéo-bronchique, ces molécules dérivent d’un tissu conjonctif vascularisé entourant le tissu cartilagineux : le périchondre.
b) le tissu cartilagineux fibreux : encore nommé fibrocartilage, il diffère du cartilage hyalin par la présence abondante de fibres de collagène type I. Ces fibres forment des faisceaux orientés détectables en microscopie optique après coloration au trichrome de Masson (ou au Jaune Safran).
Par conséquent la matrice de ce tissu cartilagineux ne peut être considérée comme amorphe. Le fibrocartilage est présent au niveau du tendon d'Achille (plus exactement au niveau du point d'insertion du tendon d'Achille), des ménisques et des disques intervertébraux.
c) le cartilage élastique : le cartilage élastique est caractérisé par l'abondance des chondrocytes et par la présence d'un réseau tridimensionnel de fibres élastiques(fibres que l'on peut détecter par une coloration à l'orcéine).
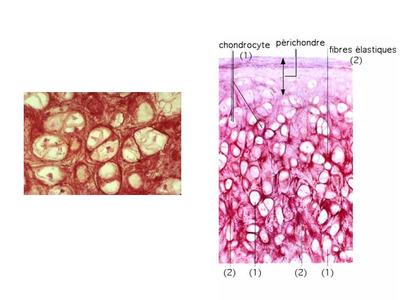
Le tissu cartilagineux élastique est localisé essentiellement au niveau des ailes du nez, des pavillons de l'oreille et de l'épiglotte.
II) le tissu cartilagineux immature : il est essentiellement observé chez le foetus mais également chez l’enfant et l’adolescent ou il participe à la croissance osseuse post-natale.
1) les cellules : contrairement au tissu cartilagineux mature, le tissu cartilagineux immature contient des cellules à riche activité mitotique. Selon le mode de croissance cartilagineuse, il peut s’agir de chondroblastes (précurseurs des chondrocytes) ou des chondrocytes eux-mêmes.
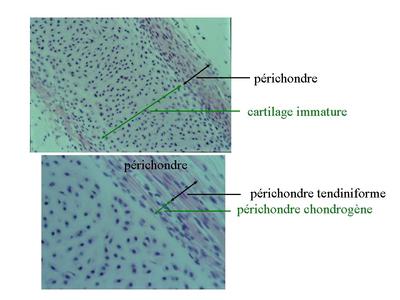
a) la croissance dite appositionnelle (ou périchondrale) : s’opère par prolifération puis différenciation de chondroblastes en chondrocytes. Dans ce cas, les chondroblastes dérivent de cellules souches mésenchymateuses localisées dans la couche la plus interne du périchondre, le périchondre chondrogène. Celui-ci forme un tissu conjonctif lâche (pauvre en fibres et richement vascularisé) qui se distingue de la couche externe du périchondre nommée couche tendiniforme qui est formée de tissu conjonctif dense. La croissance appositionnelle est essentiellement observée au cours du développement fœtal.
b) la croissance interstitielle : elle s’effectue par mitoses successives des chondrocytes eux-mêmes. Dans ce cas, les cellules filles d’un même clône cellulaire s’éloignent de la cellule mère en se disposant soit de manière rectiligne soit de manière circulaire. Elles forment ce qu’on appelle des groupes isogéniques axiaux ou coronaires. Ces différentes dispositions permettent la croissance axiale ou circonférentielle du cartilage.
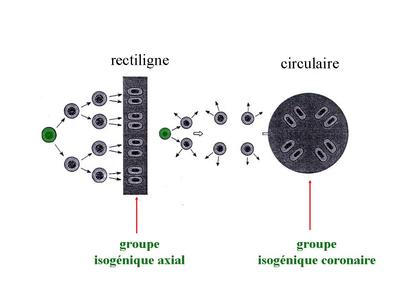
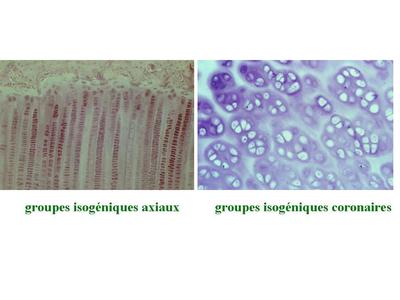
Durant ce processus on observe souvent la présence de plusieurs chondrocytes au sein du même chondroplaste. La croissance interstitielle est observée chez le foetus mais également au cours de la croissance osseuse post-natale des os long. En effet jusqu'à la puberté, la métaphyse des os longs renferme un cartilage de croissance nommé cartilage de conjugaison qui participe à la croissance osseuse.
2) la matrice : La matrice du tissu cartilagineux immature proche de la matrice du cartilage mature hyalin mais présente un certain nombre de spécificités. On retient en particulier la présence non négligeable de collagène IX.
III) Tissu cartilagineux et développement osseux : le développement du tissu osseux s'effectue schématiquement en 2 phases qui sont :
i) l'ossification primaire c'est-à-dire la formation initiale du tissu osseux chez le foetus,
ii) l’ossification secondaire c’est-à-dire la croissance et la maturation osseuse qui s'achèvent à la fin de la puberté.
1) tissu cartilagineux et ossification primaire : on désigne sous le terme d'ossification endochondrale la transformation d'un tissu cartilagineux hyalin en tissu osseux. Ce type d’ossification est à distinguer de l’ossification dite endoconjonctive qui consiste en la transformation osseuse d’un tissu conjonctif non spécialisé (Pour mémoire : cette ossification endoconjonctive est observée au niveau du périoste qui entoure la diaphyse des os long ; on parle d’ossification périostique). Dans les os longs, l'ossification primaire endochondrale débute au centre de la diaphyse par un processus d'hypertrophie des chondrocytes. Celui-ci s'accompagne de 3 évènements :
i) l'élargissement des chondroplastes au dépend de la MEC
ii) la synthèse de facteurs angiogéniques dont le VEGF ("vascular endothelial growth factor") induisant la vascularisation locale du tissu cartilagineux
iii) la calcification du tissu cartilagineux (calcification n'équivaut pas à ossification).
Puis, la phase initiale d’hypertrophie des chondrocytes s’achève par leur mort cellulaire programmée (apoptose). Les chondroplastes élargis sont donc vidés de leur contenu et vont devenir confluents. Ils sont alors séparés par des travées de tissu cartilagineux calcifié et vascularisé. Les vaisseaux sanguins pénètrent alors dans les chondroplastes confluents et permettent l'arrivée de cellules souches mésenchymateuses circulantes qui vont générer des ostéoblastes. Les ostéoblastes permettent l'ossification des travées de tissu cartilagineux et conduisent à la formation d'un point d'ossification primaire au centre de la diaphyse. Par la suite, on observera de proche en proche le recrutement et la prolifération de nouveaux chondrocytes entourant le front d’ossification. Dans les os longs, lorsque l'ossification primaire de la diaphyse est suffisamment avancée, débute l'ossification primaire des épiphyses. Il s'agit également d'une ossification endochondrale évoluant de manière centrifuge à partir d'un point d'ossification centro-épiphysaire. Cette ossification préserve une zone de cartilage articulaire en regard de la cavité synoviale et une zone de cartilage immature (le cartilage de conjugaison) au niveau de la métaphyse.
L'ensemble du processus d'ossification primaire ne conduit en fait qu'à l’ossification de travées de tissu cartilagineux : on parle d'os primaire endochondral (os immature, non lamellaire, Cf. cours tissu osseux). Lors d'une deuxième phase qui s'étend jusqu'à la fin de la puberté se déroule l'ossification secondaire c'est-à-dire d'une part le remplacement complet de cet os immature par un os mature dit lamellaire, et d'autre part la croissance en longueur et en épaisseur des os. (Pour mémoire : tout phénomène de réparation osseuse, après fracture par exemple, s’accompagne d’une récapitulation des phénomènes caractérisant l’ossification endochondrale. On observe ainsi la formation initiale d’un modèle cartilagineux au sein duquel les chondrocytes dérivent de cellules souches mésenchymateuses. Ce modèle cartilagineux se calcifie et est progressivement remplacé par du tissu osseux).
2) tissu cartilagineux et ossification secondaire : la croissance en longueur des os est de type endochondral et fait intervenir les cartilages de conjugaison. Le cartilage de conjugaison est organisé en colonnes et en couches successives qui sont individualisables en microscopie optique. La zone du cartilage hyalin la plus éloignée du front d’ossification constitue une réserve de chondrocytes au repos. Puis on trouve une zone de cartilage sérié ou les chondrocytes prolifèrent et s’aplatissent.
Enfin, à proximité du front d’ossification se trouve une zone dite de cartilage hypertrophié ou les chondrocytes augmentent leur volume par un facteur de 5 à 10.
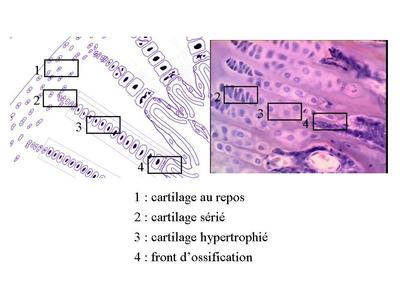
Les chondrocytes hypertrophiés vont exercer les fonctions suivantes :
i) calcification de la matrice cartilagineuse,
ii) vascularisation du tissu cartilagineux,
iii) recrutement puis différenciation ostéoblastique de cellules souches mésenchymateuses. On considère que ces cellules souches proviennent du tissu conjonctif non spécialisé associé au tissu osseux (endoste, périoste, tissu conjonctif associé à la moelle osseuse rouge).
Pour méméoire : La croissance en épaisseur des os longs n’est pas de type endochondral et se fait par apposition de couches successives de lamelles osseuses à partir du périoste. Il s'agit d'une croissance endoconjonctive au cours de laquelle on observe la différenciation de cellules souches mésenchymateuses en ostéoblastes, sans intervention d’un autre type cellulaire et san migration par vois sanguine des cellules souches mésenchymateuses.
3) contrôle moléculaire de l'ossification endochondrale :
a) facteurs systémiques : pendant toute la période de croissance post-natale, la croissance en longueur des os longs est sous la dépendance de facteurs hormonaux agissant essentiellement sur les cartilages de conjugaison. Il s’agit principalement de l’IGF1 (dont l’hormone de croissance GH stimule la production par le foie) et des hormones sexuellesi.e. les oestrogènes chez la femme et les androgènes chez l’homme. (Rappel sur le mode de fonctionnement des hormonse storoïdes) Ce contrôle hormonal explique la poussée de croissance osseuse au moment de la puberté. Il faut noter que les chondrocytes n’expriment que des récepteurs aux oestrogènes et non aux androgènes. L’effet des androgènes chez le garçon nécessite l’action d’une enzyme intracellulaire qui métabolise les androgènes en oestrogènes. À l’issue de cette période, le stock de chondrocytes contenus dans le cartilage de conjugaison est épuisé, le cartilage de conjugaison est totalement remplacé par du tissu osseux et la taille définitive de l’individu est atteinte.
b) facteurs locaux : les chondrocytes hypertrophiés synthétisent un ensemble de molécules qui permettent : i) soit l’ossification du cartilagineux immature au cours de l’ossification primaire, ii) soit l’ossification des cartilages de croissance au cours de l’ossification secondaire.
i) le VEGF : le « vascular endothelial growth factor » est un puissant agent angiogénique permettant la formation de vaisseaux (on parle de néovascularisation) dans la zone des chondrocytes hypertrophiés. Cette vascularisation permet i) un soutien nutritif et métabolique ii) le contrôle moléculire sytémique par les facteurs solubles sanguins décrits plus haut, iii) la l’apport de cellules souches mésenchymateuses sanguines (uniquement chez le foetus). Par ailleurs, le VEGF exerce une activité chimiotactique (c’est-à-dire une activité d’induction de la migration) sur les ostéoblastes, permettant ainsi de diriger leur migration vers la zone d'ossification.
ii) la molécule Indian Hedgehog (IHH) : il s’agit d’un polypeptide synthétisé par les chondrocytes hypertrophiques ou pré-hypertrophiques. Indian Hedgehog agit sur 3 phases essentielles de l’ossification :
i) la prolifération des chondrocytes,
ii) leur différenciation en chondrocytes hypertrophiés,
iii) la maturation des ostéoblastes.
Pour mémoire : Il existe une pathologie humaine, nommée brachydactylie, qui est liée à une mutation de l’IHH. Cette pathologie est caractérisée par la longueur anormalement faible des phalanges et des métacarpes.
IV) pathologies du tissu cartilagineux :
1) pathologies mécaniques et dégénératives : elles concernent essentiellement les cartilages articulaires et les fibrocartilages.
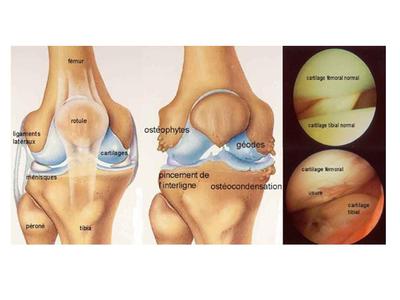
a) l’arthrose Elle peut toucher de nombreuses articulations mais en particulier la hanche (coxarthroes), le genou (gonarthrose) et la colonne vertébrale. Elle se traduit par 1) l’amincissement puis la disparition du cartilage (la disparition du cartilage s’accompagne au plan radiologique par la disparition de l’interligne articulaire); 2) une densification réactionnelle et des micro-fractures de l'os sous-chondral ; 3) la formation d’excroissances ostéocartilagineuses nommées ostéophytes . Puis on observe la disparition complète du cartilage et la survenue de lésions osseuses par frottement. La coxarthrose primitive survient le plus souvent entre 50 et 70 ans et est considérée comme d’origine multifactorielle (facteur héréditaires + facteurs aggravants tel que l’obésité et les microtraumatismes). L'arthrose secondaire survient plus précocement chez des sujets aux antécédents de traumatisme, d’anomalies de croissance ou d'anomalies de développement tel que la luxation bilatérale de hanche (pathologie actuellement détectable et traitable à la naissance).
b) lésions des fibrocartilages : l’atteinte dégénérative des fibrocartilages est fréquente au-delà de 50 ans. On peut observer en particulier une dégénérescence des disques intervertébraux responsables d’une atteinte neurologique (sciatique). Au niveau des genoux, une fissuration ou une fracture des ménisques peut être observée. La rupture du tendon d’achille peut également survenir.
2) pathologies inflammatoires : la polyarthrite rhumatoïde a pour point de départ l’inflammation du liquide synovial et la proliferation des synoviocytes. Les synoviocytes sont des fibroblastes spécialisés formant la membrane interne de la capsule articulaire : la membrane synoviale. Cette membrane est un tissu conjonctif lâche dont la composition cellulaire comprend des adipocytes, des synoviocytes et des cellules immunes de passage (lymphocytes, mastocytes, macrophages, cellules dendritiques). Les synoviocytes synthétisent le liquide synoviale qui lubrifie et nourrit le tissu cartilagineux. Au cours de la polyarthrite rhumatoïde on observe une prolifération des synoviocytes l’augmentation de volume du liquide synovial et le déclenchement parallèle d’une réaction auto-immune dirigée essentiellement contre le collagène de type II. L’atteinte inflammatoire du tissu cartilagineux s’accompagne d’un recrutement et d’une activation des ostéovclastes conduisant à une destruction de l’os sous-chondral. L’une des avancées thérapeutique majeure des dernières années est l’utilisation d’une molécule inhibitrice du TNF alpha qui bloquerait, entre autres, l’activité accrue des ostéoclastes au niveau de l’os sous-chondral. Dans certains cas, la polyarthrite rhumatoïde peut être associée à des manifestations extra-articulaires et entrer alors dans le cadre plus large des collagénoses c’est-à-dire une atteinte généralisée (on parle de maladie systémique) des tissus contenant du collagène donc essentiellement les tissus conjonctifs.
![]()