
I) La myéline du système nerveux central
1) Les oligodendrocytes : on distingue deux types d’oligodendrocytes. Les oligodendrocytes myelinisants, encore appelés oligodendrocytes interfasciculaires, forment la gaine de myéline entourant la plupart des axones du système nerveux central. Les oligodendrocytes non myélinisants, encore appelés oligodendrocytes satellites, sont localisés à proximité des corps cellulaires neuronaux. Nous n’aborderons ici que les oligodendrocytes myélinisants. En microscopie électronique, les oligodendrocytes myélinisants ont un corps cellulaire petit, de 6 à 8 microns de diamètre, rond, avec un cytoplasme foncé quie ne contient pas de gliofilament (à la différence des astrocytes). Chaque oligodendrocyte envoie des prolongements de sa membrane plasmique s'enroulant autour de plusieurs axones adjacents.
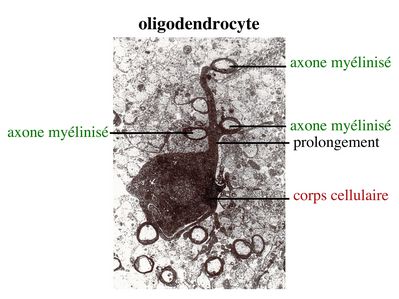
2) formation et ultrastructure : la gaine de myéline est constituée par l’enroulement compact, en spirale, de la membrane plasmique des oligodendrocytes. Cette gaine de myéline recouvre les axones par segments courts de 1mm de long, interrompus par des espaces non myélinisés, appelés noeuds de Ranvier.
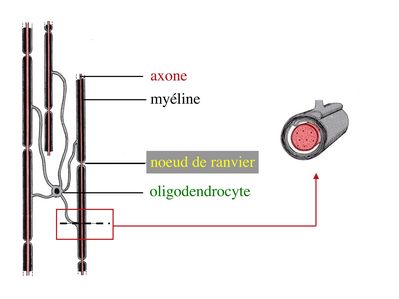
Au niveau des noeuds de Ranvier, longs de quelques microns, l’axone est dénudé, présente un renflement de son cytoplasme et exprime un certain nombre de molécules spécifiques, notamment des canaux sodium.
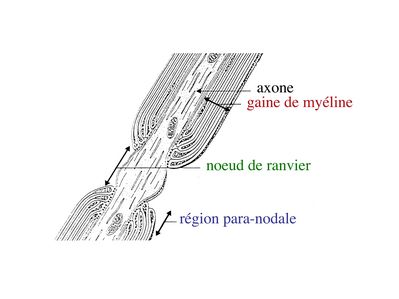
Par ailleurs, on observe au niveau du noeud de Ranvier la présence de pieds astrocytaires (astrocytes de type 2) faisant contact avec la membrane plasmique axonale. À proximité des noeuds de Ranvier, la gaine de myéline s’interrompt de manière échelonnée le long de l’axone, en délimitant la région paranodale .
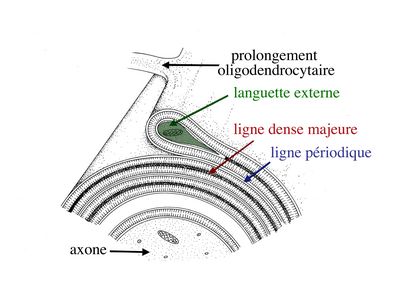
Au cours du développement, le prolongement d’un oligodendrocyte doit s’enrouler environ 40 fois autour de l’axone pour former la gaine de myéline. Dans cet enroulement de membrane plasmique, la partie la plus interne, au contact de l’axone, est appelée languette interne. La partie la plus externe de l’enroulement est appelée languette externe.
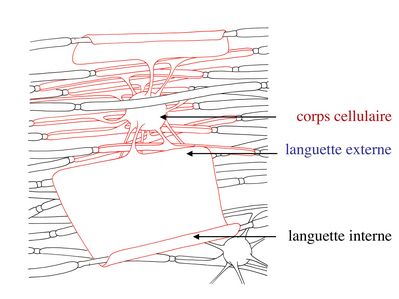
Dans la partie enroulée et compactée de la gaine de myéline, le cytoplasme oligodendrocytaire, localisé entre les feuillets internes de la membrane plasmique, disparaît complètement. Ainsi, les feuillets internes s’accolent et forment la ligne dense majeure. Les feuillets externes de la membrane plasmique oligodendrocytaire s’accolent également, mais en laissant persister un espace extracellulaire qui va constituer la ligne claire ou ligne périodique.
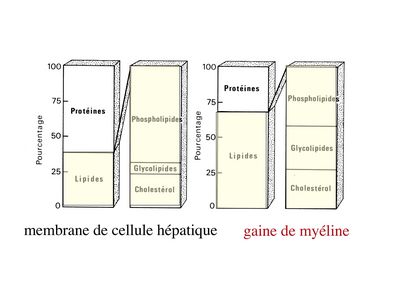
3) composition biochimique : à la différence de la membrane plasmique de la très grande majorité des cellules de l'organisme, la membrane plasmique constituant la gaine de myéline est composée à 70% de lipides. Parmi ceux-ci, certains sont caractéristiques de la myéline tels que le galactocéramide (ou galactosyl-céramide). La fraction protéique de la gaine de myéline comprend un certain nombre de molécules spécifiques tel que la protéine basique de la myéline (MBP pour "myelin basic protein"), la MOG ("myelin oligodendrocyte glycoprotein") et la MAG ("myelin associated glycoprotein") (la MAG est une protéine minoritaire de la myéline centrale alors qu'elle est majoritaire dans la myéline périphérique).
4) fonctions : du fait de sa forte teneur en lipides, la gaine de myéline est imperméable aux éléments hydrophiles constitue donc un bon "isolant électrique" entre le milieu intracellulaire, c'est-à dire le cytoplamse axonal, et le milieu extracellulaire. En facilitant la conduction de l’influx nerveux au niveau des segments myélinisés de l’axone, la gaine de myéline détermine le caractère saltatoire de la conduction nerveuse c'est-à-dire une conduction par sauts rapides d’un noeud de Ranvier à un autre. Les fibres myélinisées dont les axones sont les plus larges ont les gaines de myéline les plus épaisses (donc le plus grand nombre de tours de spire), les internodes les plus longs (internode = distance entre 2 noeuds de Ranviers consécutifs) et la vitesse de conduction la plus élevée.
5) pathologie : chez l'adulte jeune, la pathologie la plus fréquente de la myéline du système nerveux central est la sclérose en plaques. Il s'agit d'une maladie auto-immune au cours de laquelle les antigènes cible sont les protéines de la myéline du système nerveux central, et enparticulier la MBP et la MOG. On observe la présence de multiples zones de démyélinisation, disséminées dans le système nerveux central et le plus souvent accompagnées d'une infiltration lymphocytaire et macrophagique. Au plan clinique, la sclérose en plaques se caractérise le plus souvent par la survenue d'épisodes transitoires de déficit sensitifs, moteurs ou sensoriels. Ces épisodes transitoires laissent parfois des séquelles qui, au fil du temps, peuvent conduire à un handicap majeur.
II) la myéline du système nerveux périphérique :
1) cellules de Schwann : à la différence des oligodendrocytes qui peuvent myélinisés plusieurs axones, une cellule de Schwann ne myélinise qu’un axone. Chaque cellule de Schwann forme une gaine de myéline sur un segment limité d'un axone.
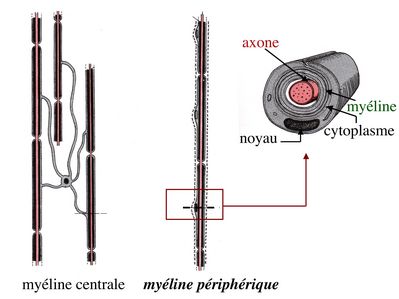
Les axones périphériques myélinisés sont ainsi associés à un ensemble de cellules de Schwann reposant sur une lame basale. Il existe également des cellules de Schwann non myélinisantes qui sont associées aux axones périphériques non myélinisés ou qui sont localisés dans les ganglions végétatifs ou sensitifs.
2) formation et ultrastructure : la formation et l'ultrastructure de la myéline périphérique sont similaires à celles de la myéline centrale.
3) composition biochimique : la myéline périphérique ne présente pas la même composition biochimique que la myéline centrale, en particulier au niveau protéique. On retient la présence abondante de protéine P0, de MAG ("myelin associated glycoprotein") et de PLP ("peripheral lipoprotein").
4) pathologie : au cours des neuropathies à IgM avec anticorps anti-MAG, une immunoglobuline de type M synthétisée par un clône lymphocytaire B à prolifération non contrôlé reconnaît la protéine myélinique MAG. On observe alors en microscopie électronique un aspect caractéristique de myéline décompactée.
III) la microglie :
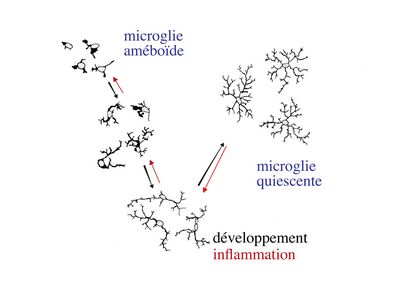
Les cellules microgliales représentent environ 5% de l'ensemble des cellules du système nerveux central. À la différence des autres cellules nerveuses qui dérivent du neurectoderme, les cellules microgliales dérivent de cellules souches hématopoïétiques (donc du mésoderme) et appartiennent au système immunitaire. La microglie constitue la population de macrophages tissulaires spécifiques du système nerveux central. La morphologie des cellules microgliales varie en fonction de leur état d’activation. Au cours du développement cérébral, la microglie est activée et présente une morphologie améboïde (ou amiboïde) car elle est globalement ovalaire avec de très courts prolongements cytoplasmiques. Elle participe alors essentiellement à l’élimination des débris cellulaires amis également à l’élimination ciblée de populations neuronales. Ultérieurement, au cours de la maturation du système nerveux central, la microglie activée se différencie en microglie quiescente (microglie au repos). Elle adopte progressivement une morphologie ramifiée avec un corps cellulaire qui devient petit et ovoïde. Des données récentes montrent que les ramifications de la microglie quiescente sont en mouvement constant, alors que le corps cellulaire reste fixe. On considère que ces mouvements permettent une immunosurveillance de l’ensemble du périmètre couvert par les ramifications microgliales. En situation inflammatoire, on observe une activation des cellules microgliales caractérisée au plan morphologique par une rétraction des ramifications et une hypertrophie du corps cellulaire. Au plan fonctionnel, cette activation s’accompagne d’une augmentation de la capacité de phagocytose, de l’expression de molécules d’histocompatibilité classe II et de la synthèse de cytokines pro-inflammatoires.
IV) les épendymocytes :
1) cytophysiologie générale : les épendymocytes tapissent la paroi de cavités localisées au coeur du tissu nerveux qui sont les cavités ventriculaires au niveau du cerveau et le canal de l’épendyme au niveau de la moelle épinière. Ces cavités sont remplies d’un liquide paucicellulaire (contenant peu de cellules) dans lequel baigne l’ensemble du système nerveux central: le liquide cépahlorachidien (LCR).
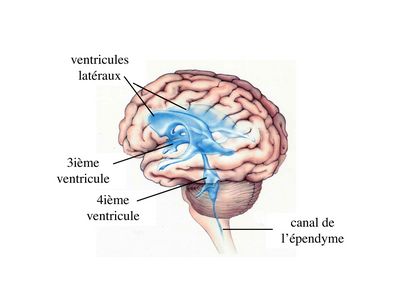
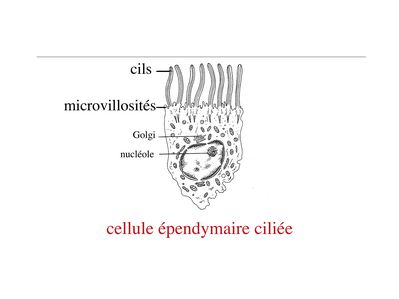
Les cellules épendymaires sont des cellules polarisées présentant un pôle apical en contact avec le LCR. On observe, au niveau du domaine apical, une différenciation de la membrane plasmique sous forme de cils et/ou de microvillosités. Par ailleurs, les cellules épendymaires sont réunies par des jonctions gap. Il existe deux types de cellules ependymaires : les cellules épendymaires ciliées et les tanicytes.
2) les cellules épendymaires ciliées : elles présentent de nombreux cils et microvillosités se projetant au contact du LCR et dont le rôle est de faciliter la circulation du LCR.
3) les tanicytes : leur surface apicale présente uniquement des microvillosités alors que sur leur versant basal, ils envoient de longs prolongements. Ceux-ci établissent des contacts, dans le parenchyme nerveux, avec des capillaires sanguins, des neurones et des astrocytes.
4) rôle des épendymocytes : outre leur fonction dans la circulation du LCR, les cellules épendymaires et notamment les tanicytes participent aux échanges LCR/parencyme via l’absorption coté apical puis la sécrétion coté basal d’hormones, de neuromédiateurs ou d’autres molécules contenues dans le LCR. Une autre fonction des cellules épendymaires est de former une niche pour les cellules souches neurales localisées dans la couche dite sous-épendymaire bordant la paroi des ventricules cérébraux.
V) la barrière hémato-encéphalique : l’une des principales caractéristiques du SNC est d’être inaccessible à un grand nombre de molécules sanguines qui pénètrent pourtant librement, ou de façon faiblement restreinte, dans la plupart des autres tissus de l’organisme. De la même façon, la circulation des cellules immunes depuis le sang vers le système nerveux central est très limitée alors que l'immunosurveillance des autres tissus de l'organisme est assurée grâce au trafic tissulaire de cellules immunes sanguines. Cette propriété du système nerveux central est due à la présence d’une barrière dite "hémato-encéphalique", terme qui désigne l’ensemble des mécanismes qui restreignent les échanges entre d’une part le sang et d’autre part le LCR et le parenchyme nerveux. Ainsi, la barrière hémato-encéphalique regroupe trois interfaces ou barrières.
1) la barrière hémato-tissulaire (interface sang/parenchyme cérébral) : elle intéresse les échanges qui se font directement entre le sang et le parenchyme cérébral au niveau des capillaires sanguins.
a) structure des capillaires "cérébraux" (capillaires du système nerveux central) : les capillaires cérébraux sont formés d’une monocouche de cellules endothéliales reposant sur une membrane basale continue qui se dédouble par endroits pour accueillir des péricytes (cellules musculaires lisses assurant la contractilité des microvaisseaux) et des macrophages dénommés macrophages périvasculaires.
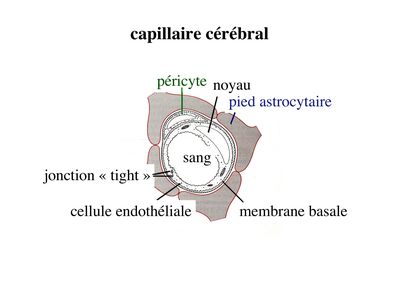
Cet endothélium se différencie des autres capillaires de l’organisme par un ensemble de caractéristiques dont les principales sont :
- la présence de jonctions serrées réunissant les cellules endothéliales
- la rareté des vésicules endothéliales
- la présence d'un équipement enzymatique riche et parfois spécifique
- l'absence de tissu conjonctif périvasculaire içi remplacé par les prolongements astrocytaires des astrocytes de type 1.
b) fonctions :
*contrôle du passage des molécules : les macromolécules ne franchissent pas la barrièrela hématotissulaire et, pour les petites molécules, la perméabilité est identique à celle d’une membrane cellulaire. On observe donc le passage libre des molécules lipophiles et la nécessité de transporteurs membranaires, parfois spécifiques, pour les molécules hydrophiles.
* contrôle du passage des cellules : à l’état physiologique, le franchissement des capillaires cérébraux par des cellules sanguines est essentiellement réduit au renouvellement lent mais constant des cellules microgliales par des précurseurs dérivant de la moelle osseuse.
c) pathologie : il faut distinguer les situations de lésion de la barrière hématotissulaire des situations d'altération fonctionnelle de cette barrière. Ainsi, une véritable "une rupture" de la barrière hématotissulaire peut-être observée en cas de lésion directe de l’endothélium par un traumatisme, une ischémie cérébrale (défaut transitoire ou définitif de l'apport sanguin d'un territoire cérébral), ou une invasion tumorale. On observe alors un oedème cérébral lié au passage de macromolécules, d’ion et d’eau. Une altération fonctionnelle sans lésion directe de la barrière est observée au cours de processus inflammatoires tel que la sclérose en plaques. On observe alors une activation de l'endothélium responsable de l'infiltration du parenchyme nerveux par des cellules immunes.
2) la barrière hémato-liquidienne : elle intéresse les échanges entre le sang et le LCR. Elle correspond morphologiquement à deux structures qui sont les plexus choroïdes et les villosités arachnoïdiennes assurant respectivement la production et la résorption du LCR.
a) les plexus choroïdes : ce sont des structures d'aspect villositaire, appendues à la paroi des ventricules cérébraux et constituées d’un stroma et d’un épithélium.
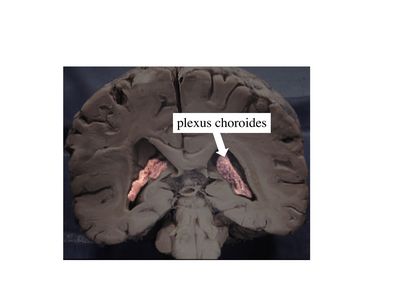
Le stroma des plexus choroïdes contient des vaisseaux qui n'ont pas la structure des capillaires cérébraux et qui laissent passer plus ou moins librement cellules et molécules.
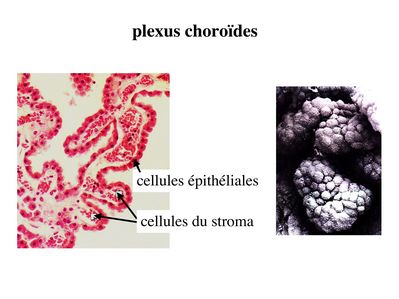
La véritable barrière est formée par l'épithélium choroidien qui recouvre le stroma. Le rôle des plexus choroides est de maintenir la composition protéique et cellulaire du LCR qui est caractérisé entre autres par la quasi-absence de cellules (liquide paucicellulaire) par par l’absence de macromolécules. Les plexus choroides jouent également un rôle de filtre vis-à-vis des micro-organismes et des molécules potentiellement neuro-toxiques.
b) Les villosités arachnoïdiennes : encore appelées granulations de Pacchioni, ce sont des expansions de l’espace sous-arachnoïdien faisant saillie dans la lumière du sinus veineux longitudinal supérieur lui-même localisé dans la dure-mère (tunique méningée la plus externe).
3) l’interface LCR/parenchyme nerveux : les surfaces internes et externes du parenchyme nerveux sont en contact avec le LCR au niveau des interfaces épendymaires et piogliales.
a) l’interface épendymaire : elle contrôle les échanges entre le LCR et le parenchyme nerveux au niveau des cavités ventriculaires et du canal de l’épendyme. Les épendymocytes sont réunis par des jonctions de type gap et permettent soit un passage passif de molécules vers la matrice extra cellulaire du parenchyme soit un transport actif de molécules spécifiques qui seront essentiellement recaptées par les astrocytes et/ou les neurones.
b) l’interface piogliale : cette interface est localisée entre d'une part le liquide céphalorachidien, qui circule entre les tuniques méningées externes et internes, et d'autre part la surface externe du système nerveux central. L'interface piogliale comprend une composante gliale, la glia limitans (Cf cours sur les astrocytes) et une composante méningée, la pie-mère, qui constitue la tunique méningée la plus interne.
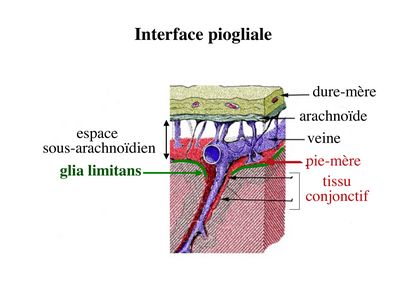
On considère que l'interface piogliale restreint faiblement les échanges entre LCR et parenchyme nerveux.
![]()