1) pathologies neurodégénératives : il s’agit d’un ensemble de pathologies qui se caractérise par une dégénérescence neuronale chronique et progressive qui concerne plus ou moins spécifiquement une ou plusieurs sous-populations neuronales. Le meilleur exemple est donné par la plus fréquente des maladies neurodégénératives : la maladie d’Alzheimer. Au cours de cette pathologie, on observe une perte diffuse des neurones de l’encéphale. Cette dégénérescence bien que diffuse touche préférentiellement 2 zones : le cortex cérébral et l’hippocampe. En particulier, on observe une atteinte précoce des neurones cholinergiques de l’hippocampe qui est responsable des troubles de la mémoire constituant l’essentiel des signes cliniques aux stades initiaux de la maladie. La correction du déficit cholinergique par un inhibiteur de la cholinestérase permet de retarder transitoirement la progression des troubles de mémoire mais pas la dégénérescence diffuse. Cette perte neuronale est responsable d’une atrophie cérébrale c’est-à-dire une diminution du volume de tissu cérébral.
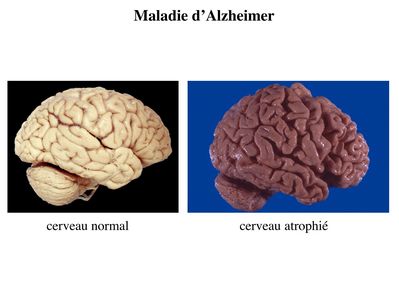
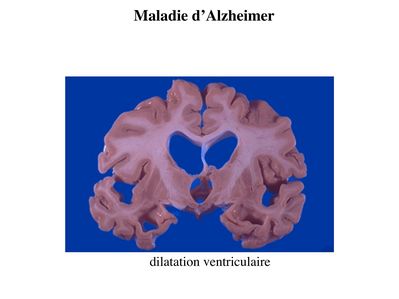
Ce vide tissulaire est comblé par une augmentation parallèle du volume liquidien occupé par le liquide céphalorachidien. On observe ainsi augmentation de la taille des ventricules cérébraux et des sillons corticaux.
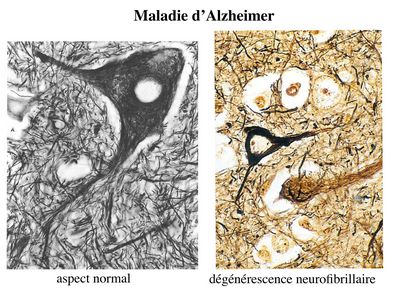
Cette perte neuronale est associée à 2 types de lésions : des lésions dégénérescence neurofibrillaire et des plaques amyloïdes.
Les lésions de dégénérescence neurofibrillaire sont des anomalies intraneuronales caractérisées par une accumulation de protéine Tau. Dans les neurones des patients Alzheimer, cette protéine est anormalement phosphorylée, s’accumule dans le cytoplasme et entraîne une désorganisation du cytosquelette.
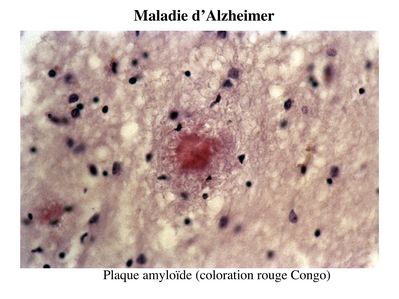
Les plaques amyloïdes encore appelées plaques séniles sont des lésions extracellulaires résultant de l’agrégation d’un peptide appelé Amyloïde ß.
Une controverse a opposé les scientifiques au sujet du rôle respectif de ces 2 types de lésions. Les « tauistes » estimaient que la dégénérescence neurofibrillaire précède les dépôts amyloïdes et sont la cause de la dégénérescence neuronale. Les « myéloïstes » estimaient que les plaques amylmoïdes précèdent le développement de la neurodégénérescence fibrillaire. Aujourd’hui on considère que la maladie d’Alzheimer est primitivement liée au dépôts de plaques amyloïdes, sur la base des arguments suivants :
i) il existe des formes familiales de maladie d’Alzheimer, qui sont liées à une mutation de la protéine amyloïde,
ii) on peut reproduire chez des souris transgéniques certains aspects anatomopathologiques et fonctionnels de la maladie d’Alzheimer en provoquant génétiquement un excès de production intracérébral de la protéine amyloïde. iii) chez la souris et chez l’homme, une vaccination contre la protéine amyloïde permet une élimination des plaques amyloïdes et une régression des déficits fonctionnels. (toutefois, chez l’homme le vaccin anti-amyloïde s’accompagne d’effets secondaires encore trop importants).
Enfin, des données récentes obtenues sur la base de recherches épidémiologiques montrent que l’hypercholestérolémie est un facteur de risque important de la maladie d’Alzheimer. Le lien physiopathologique entre maladie d’Alzheimer et hypercholestérolémie reste à élucider.
Dans le cas de la maladie de Parkinson, ce sont les neurones dopaminergiques des noyaux gris centraux (noyaux de neurones contenant des grains de mélanine) qui sont initialement atteints.
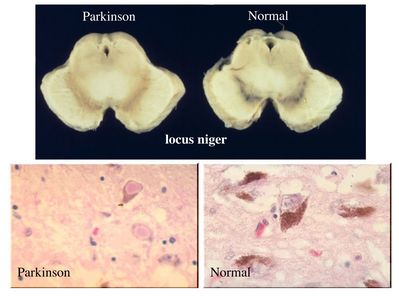
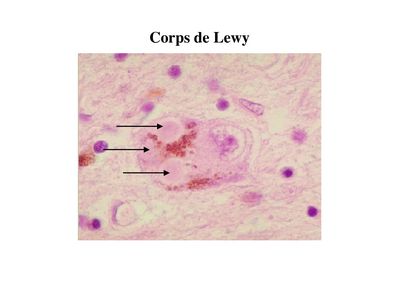
Ces neurones contiennent des inclusions éosinophiles : les corps de Lewy.
On considère qu’au moment des premiers signes cliniques, déjà près de 70% des neurones dopaminergiques est dégénéré. Le traitement actuel est purement symptomatique et vise à compenser le déficit dopaminergique en apportant un précurseur de la dopamine que les neurones "survivants" pourront métaboliser en dopamine. Différents types de greffes de cellules sont en cours d’évaluation chez l’homme ou chez l’animal : greffes de neurones foetaux, greffes de cellules souches, greffes de neurones dopaminergiques obtenus par différenciation de cellules souches embryonnaires.
Dans le cas de la sclérose latérale amyotrophique, ce sont les neurones moteurs de la moelle épinière qui sont principalement touchés. Les signes cliniques sont purement moteurs, et s’étendent en quelques années aux muscles respiratoires. Il s’agit d’une maladie fatale, sans traitement connu.
2) pathologies infectieuses : Un certain nombre de pathologies infectieuses du système nerveux central s’accompagnent d’une atteinte neuronale parfois prépondérante. C’est le cas de certaines encéphalites virales, l’encéphalite herpétique par exemple, et du NeuroSIDA. Au cours du NeuroSIDA, on observe une atteinte du système nerveux central qui n’est pas liée à une infection par un germe opportuniste mais à l’infection chronique du tissu nerveux par le VIH. On considère que dans ce cas, le système nerveux central pourrait constituer une zone sanctuaire, inaccessible aux traitements antiviraux, et dans laquelle le VIH pourrait muter avant de réensemencer l’organisme.
II) les Astrocytes :
1) Cytophysiologie générale :
Au sein du SNC, les cellules de la névroglie sont deux fois plus nombreuses que les neurones et sont majoritairement astrocytaires (dessin Ramon y Cajal, 1907) Les astrocytes sont de petites cellules étoilées dont le corps cellulaire à un diamètre d'environ 10 microns et dont les prolongements cellulaires s'étendent de façon radiée. Au plan ultrastructural, les astrocytes présentent 3 principales caractéristiques :
* la présence de filaments intermédiaires particuliers, les gliofilaments. Ces filaments intermédiaires sont groupés en faisceaux et sont composés d'une protéine spécifique des astrocytes : la GFAP, "glial fibrillary acidic protéin" ou protéine acide gliofibrillaire.
* la présence de grains de glycogène , absent des autres cellules nerveuses, disséminées dans le corps cellulaire, les prolongements cytoplasmique et plus particulièrement au niveau des extrémités distales de ces prolongements : les pieds astrocytaires.
* la présence de jonctions interastrocytaires de type "gap" qui permettent la signalisation intercellulaire via des canaux jonctionnels constitués de molécules de connexine 43. Ces jonctions sont le support anatomique de réseaux fonctionnels astrocytaires qui viennent se superposer aux réseaux neuronaux.
2) Classification :
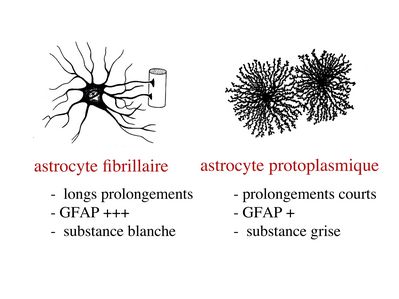
a) classification morphologique : on distingue 2 principales catégories d'astrocytes :
- les astrocytes fibrillaires (ou fibreux) présentent de longs prolongements radiaires, sont riches en gliofilaments et sont localisés préférentiellement au niveau de la substance blanche (i.e zones riches en axones myélinisés).
- les astrocytes protoplasmiques présentent des prolongements courts, contiennent peu de gliofilaments, et sont localisés préférentiellement au niveau de la substance grise ( zones riches en corps cellulaires neuronaux).
Ce sont les principales morphologies adoptées par les astrocytes mais des sous-populations astrocytaires spécifiques de certaines régions du SNC peuvent adopter d'autres morphologie. Un exemple est donné par les différents types morphologiques d'astrocytes observés dans le cervelet (planche ci-dessous):
b) classification fonctionnelle : elle ne recoupe pas la classification morphologique. On distingue :
- les astrocytes de type 1: ils jouent un rôle de barrière et leurs pieds astrocytaires établissent des contacts soit avec la paroi des capillaires (participent à la barrière hémato-tissulaire, planche ci-dessous) , soit avec les méninges ( participent à la glia limitans).
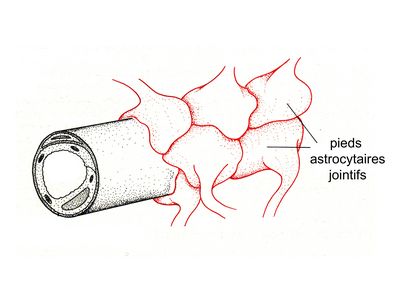
- les astrocytes de type 2 jouent un rôle de soutien métabolique et trophique vis-à-vis des neurones et des oligodendrocytes. Leurs pieds astrocytaires établissent des contacts soit avec la synapse, soit avec l'axone, soit au niveau du corps cellulaire neuronal.
3) Fonctions :
a) fonction de barrière : les astrocytes de type 1 participent à la constitution de deux barrières physiques nécesssaires à la protection du tissu nerveux.
* au niveau de la barrière hémato-tissulaire entre sang et parenchyme nerveux, les pieds astrocytaires reposant sur la membrane basale des capillaires sont jointifs, et s’opposent à la pénétration de cellules et de molécules sanguines.
* au niveau de la barrière entre liquie céphalorachidien (LCR) et parenchyme nerveux, les prolongements astrocytaires reposent sur la lame basale de la tunique interne des méninges (la pie-mère) et constituent la glia limitans.
b) fonctions métaboliques :
* apport énergétique : les astrocytes captent le glucose présent dans le liquide interstitiel du SNC en particulier au pourtour des micrvaisseaux et sont capables de le stocker sous forme de glycogène. En fonction des besoins métaboliques des neurones et des oligodendrocytes, les astrocytes catabolise le glycogène et fournissentt un apport énergétique sous forme de lactate.
* maintien de l’homéostasie ionique : la régulation de la concentration ionique et du volume extracellulaire au sein du tissu nerveux est essentiellement assurée par les astrocytes via des pompes et des transporteurs ioniques gliaux.
* régulation de la transmission synaptique : cette régulation est réalisée par recapture de neurotransmetteurs au niveau de la fente synaptique. Cette recapture concerne notamment du glutamate et s'effectue par des transporteurs spécifiques.
c) fonctions trophiques : s'ajoutant à leurs fonctions purement métaboliques, les astrocytes synthétisent un ensemble de molécules solubles ou membranaires qui conditionnent la survie et la plasticité des cellules environnantes. Parmi ces molécules, citons la famille des neurotrophines à laquelle appartient le NGF (« Nerve Growth Factor »). On sait également que les astrocytes jouent un rôle important dans l'induction de la synaptogénèse (développement et plasticité) via des molécules qui ne sont pas identifiées.
d) fonctions immulogiques : si les cellules microgliales sont les seules cellules du SNC dérivant du système immunitaire, les astrocytes bien que dérivant de cellules souches neurales exercent un certain nombre de fonctions immunitaires en situation inflammatoire. Parmi celles-çi, citons 2 fonctions essentielles :
* la synthèse de cytokines :
pour mémoire, cytokines pro-inflammatoires (IL-1, IL-6, TNF) ou anti-inflammatoires (TGF-beta)
* la présentation d'antigène aux lymphocytes T : les astrocytes sont après les cellules microgliales, les principales cellules présentatrices d'antigène au sein du parenchyme nerveux.
4) Les réseaux astrocytaires
a) généralités : Les astrocytes établissent des connexions intercellulaires de type jonctions "gap" qui permettent le passage d'ions et de molécules au sein de réseaux astrocytaires. Ces réseaux forment de véritables syncitium fonctionnels ou s'échangent et se propagent les molécules et les ions notamment les ions calcium. Ces zones d'échange peuvent ainsi s'étendre jusqu'à 300 micron au delà d'une cellule et englober le cytoplasme de plusieurs dizaines de cellules. Les connexons formant les canaux jonctionnels interastrocytaires sont exclusivement constitués de connexine 43 (pour mémoire : il existe environ 12 types de connexine codées par 2 familles géniques distinctes. Toutefois la connexine 43 n'est pas spécifiquement astrocytaire mais également synthétisée par d'autre types cellulaires à l'extérieur du SNC : cardiomyocytes par exemple). Le niveau d''expression astrocytaire de la connexine 43 et donc l'importance du couplage interastrocytaire varient in vivo en fonction de la région et de l'état de maturation du SNC. Elle peut être également fortement augmenté au cours de certaines situations pathologiques.
b) fonctions :
* homéostasie métabolique : bien que non formellement prouvé, il est admis que les réseaux astrocytaires forment des zones tampons permettant de dissiper toute modification métabolique locale. La régulation de la concentration ionique et du volume extracellulaire au sein du tissu nerveux est ainsi maintenue à l’échelle de l’astrocyte et des réseaux astrocytaires. Par ailleurs, la fonction astrocytaire de recapture des neurotransmetteurs au niveau de la fente synaptique est également facilitée par les réseaux astrocytaires qui limitent l’accumulation locale de neurotransmetteurs au sein des astrocytes péri-synaptiques.
* transfert de signaux informatifs : à l’image des synapses pour les réseaux neuronaux, les jonctions inter-astrocytaires pourraient permettrent la circulation d’informations qui coordonnent l’activité astrocytaire. Ainsi, on considère actuellement que l’activité et le niveau d’excitabilité des réseaux neuronaux est contrôlée par les réseaux astrocytaires de voisinage. Au sein des réseaux astrocytaires, le substratum de l’information n’est pas l’onde de dépolarisation mais essentiellement la concentration intracytosolique de calcium. Différents types de stimulis appliqués localement au niveau d’un astrocyte peuvent ainsi provoquer des vagues calciques. Ces vagues se propagent aux astrocytes voisins et modifient de façon coordonnée l’activité de toute une série de messagers intracellulaires.
![]()