
LE TISSU NERVEUX
I) Généralités : Le tissu nerveux comprend essentiellement 4 catégories cellulaires : les neurones, les cellules de la névroglie, les macrophages et les cellules souches neurales.
1) les neurones : le corps cellulaire de la grande majorité des neurones est localisé dans le système nerveux central (SNC) encore appelé névraxe et qui comprend la moelle épinière et l’encéphale. Seules deux catégories de neurones ont leur corps cellulaire localisé à l’extérieur du SNC : les neurones végétatifs et les neurones sensitifs. Le corps cellulaire des neurones végétatifs est localisé dans les ganglions végétatifs situés à proximité ou au sein même des tissus cibles. Le corps cellulaire des neurones sensitifs est localisé soit dans les ganglions spinaux (situés le long de la moelle épinière, à l'intérieur du canal rachidien) soit dans les ganglions des nerfs crâniens (situés dans la boite crânienne).
2) la névroglie : le terme névroglie vient de l’allemand « nerve glue », la colle des cellules nerveuses. Il désignait initialement l’ensemble des types cellulaires non neuronaux qui participent au soutien architectural des neurones. Aujourd’hui on regroupe sous le terme de névroglie les types cellulaires suivants : les astrocytres, les oligodendrocytes et les épendymocytes pour la névroglie du système nerveux central (SNC), les cellules de Schwann pour la névroglie du système nerveux périphérique.Le terme de névroglie est toutefois de moins en moins utilisé.
3) les macrophages : le système nerveux central (SNC) accueille une population de macrophages résidents et spécifiques du SNC : les cellules microgliales (encore appelées cellules de la microglie ou microglie). Les cellules microgliales sont considérées comme des cellules appartenant au système immunitaire et ne partageant pas la mêm origine que les autres cellules du SNC. On trouve également des macrophages associés au système nerveux périphérique, dans le tissu conjonctif qui accompagne le trajet des nerfs périphériques.
4) les cellules souches neurales : depuis une quinzaine d’années la notion de non-renouvellement du tissu nerveux adulte à été remise en cause. On sait en effet qu’un faible contingent de cellules souches persiste au sein du SNC mature dans des niches anatomiques spécifiques. Parmi ces niches, on retioent essentiellement la zone sous-ventriculaire et le Gyrus denté de l'hippocampe. Les cellules souches neurales participent au renouvellement permanent de certaines catégories de neurones et, le cas échéant, à la régénérescence du tissu nerveux.
II) Les Neurones
1) Généralités :
a) cytophysiologie générale :
Chaque neurone comporte un corps cellulaire émettant des prolongements cytoplasmiques, les neurites, qui sont de deux sortes : les dendrites et l’axone.
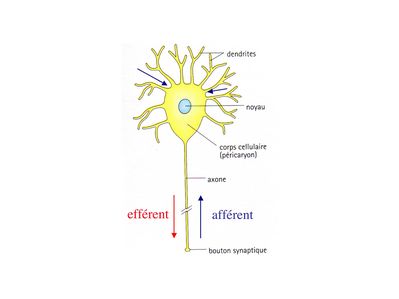
i) les dendrites, souvent multiples, et courtes ne sont jamais myélinisées. Leur surface est irrégulière et présente fréquemment des protrusions latérales, les épines dendritiques, qui portent des boutons synaptiques. Les épines dendritiques permettent ainsi d’accroître la surface de transmission synaptique.
ii) l’axone est toujours unique et parfois très long (1 mètre pour l'axone des motoneurones de la corne antérieure de la moelle épinière). Il est le plus souvent myélinisé. Il naît du corps cellulaire neuronal au niveau d’une zone présentant un certain nombre de spécificités histologiques : le cône d’implantation. L’axone peut donner des collatérales qui ont parfois récurrentes (c’est-à-dire retournant vers le corps cellulaire neuronal avant d’atteindre leur cible). Les axones transmettent des informations sous forme de potentiels de dépolarisation (potentiels d'action). Ces informations sont soit efférentes c'est-à-dire s’éloignant du corps cellulaire (c’est le cas des axones de nerfs moteurs), soit afférentes c’est-à-dire se dirigeant vers le corps cellulaire (c’est le cas des axones de nerfs sensitifs). À la différence des axones, les dendrites ne peuvent transmettre que des informations afférentes qui ne sont pas des potentiels d’action mais uniquement des potentiels inhibiteurs ou excitateurs dont la sommation s’effectue au niveau du corps cellulaire
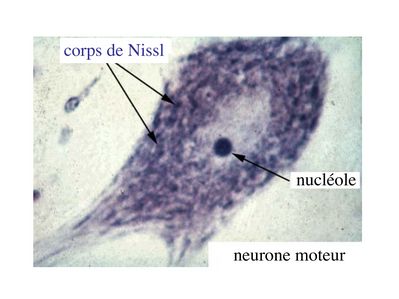
iii) Le corps cellulaire des neurones (ou soma ou périkarion ou péricarion) est centré par un volumineux noyau sphérique, contenant un ou parfois deux nucléoles denses, arrondis. En microscopie optique, différentes coloration histologiques permettent de reconnaître deux caractéristiques principales :
* la présence de mottes basophiles, les corps de Nissl, détectables après coloration au bleu de toluidine (colorant basique qui donne une couleur bleu aux composés basophiles)
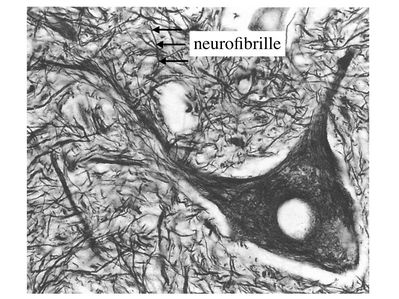
* la présence d’un fin feutrage détectable par des techniques d’imprégnations metalliques et correspondant aux éléments constituant le cytosquelette du neurone, les neurofibrilles (à ne pas confondre avec les neurofilaments).
b) classification histologique : elle est basée essentiellement sur 4 critères.
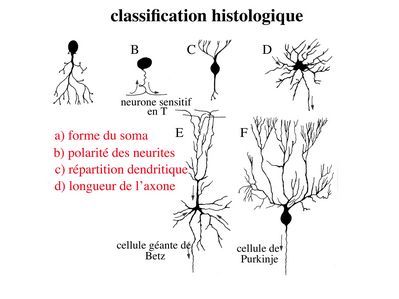
i) la forme du corps cellulaire : les corps cellulaires neuronaux peuvent revêtir des formes extrêmement variées, la forme pyramidale étant l’une des plus fréquentes. Un exemple : les cellules pyramidales du cortex cérébral ou cellules géantes de Betz qui possèdent un périkarion de 125 micron de diamètre (pour rappel, une cellule sanguine a un diamètre moyen de 10 à 15 microns) .
ii) la polarité des neurites c'est-à-dire l’organisation spatiale des prolongements neuritiques : on distingue les neurones unipolaires (toutes les neurites se dirigent vers la même direction, cas de figure rare), les neurones pseudo-unipolaire (on observe un axone se divisant à distance du corps cellulaire en un prolongement afférent et un prolongement efférent ; un seul exemple dans cette catégorie : les neurones sensitifs en T des ganglions spinaux), les neurones bipolaires (un axone d'un côté, une dendrite de l'autre, un exemple est donné par les neurones bipolaires de la rétine) , et les neurones multipolaires (un axone, plusieurs dendrites réparties dans toutes les directions de l'espace, c'est l'organisation neuritique la plus fréquente).
iii) l’arborisation dendritique : certaines classifications histologiques prennent en compte la morphologie et la répartition spatiale des dendrites.
iv) la longueur de l’axone : on distingue les neurones dont l’axone est long et que l'on nomme neurones de projection (par exemple le cellules géantes de Betz et les neurones de Purkinje localisés dans le cervelet), des neurones dont l’axone est court et que l'on nomme neurones d’association (ce sont les neurones les plus nombreux).
2) Ultrastructure :
a) le réticulum endoplasmique granulaire : il est très développé et témoigne de l’intense activité de synthèse protéique des cellules nerveuses. Le REG des neurones est organisé en amas de citernes qui correspondent aux corps de Nissl observables en microscopie optique. Ces amas de REG sont présents dans le soma et les dendrites ce qui explique la présence d’ARNm au niveau des dendrites. Le REG est par contre absent des axones et très peu abondant au niveau du cône d’implantation des axones c’est-à-dire la zone du soma d’ou émerge l’axone.
b) le cytosquelette : le cytosquelette neuronal présente un organisation et une composition moléculaires spécifiques permettant l’exercice de fonctions spécifiques comme le transport axonal.
i) les microfilaments d’actine sont répartis dans l’ensemble du cytoplasme mais sont particulièrement nombreux dans la région centrale de l’axone ou ils sont disposés parallèlement à son grand axe.
ii) les microtubules neuronaux encore appelés neurotubules sont formés par l’assemblage de polymères de tubuline alpha et beta. Les microtubules sont en permanence assemblés et desassemblés à leur deux extrémités mais suivant des vitesses différentes Ce phénomène nécessite la présence de GTP et permet de définir une polarité aux microtubules avec une extrémité se polymérisant plus rapidement notée par le signe (+) et une extrémité se polymérisant moins rapidement et notée par le signe (-). Dans les axones, à la différence des dendrites, la polarité des microtubules est uniforme et toutes les extrémités (+) sont orientées vers les terminaisons axonales. Par ailleurs, certaines protéines associées aux microtubules (MAP) sont spécifiques des neurones. Il s’agit de la protéine MAP2 et de la protéine tau qui toutes deux jouent un rôle majeur dans l’assemblage et la stabilisation des microtubules.
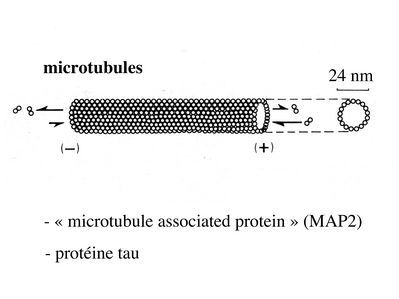
iii) les filaments intermédiaires neuronaux ou neurofilaments sont constitués par trois protéines NFP (NFP pour neurofilament proteins) de poids moléculaires différents.
c) autres composants cellulaires : outre les composants cellulaires communs à l’ensemble des cellules (reticulum endoplasmique lisse, mitochondries, lysosomes...) ont peut trouver au sein du cytoplasme de certains neurones trois types de structures, qui sont toutes granulaires :
i) des grains de lipofuscine : ce sont des amas pigmentés issus de la dégradation des lysosomes, et dont la quantité augmente avec l’âge.
ii) des grains de neuro-mélanine donnant une coloration grise sont observables dans un groupe de neurones nommé noyaux gris centraux (neurones atteints lors de la maladie de Parkinson).
iii) des grains de sécrétions sont détectables, entre autres, dans les neurones neuro-sécrétoires de l’hypothalamus, neurones qui produisent des hormones régulant les fonctions hypophysaires.
3) le flux axonal :
Un système complexe de transport axonal permet à différents composants intracellulaires, métabolites et catabolites de se déplacer dans les axones, dans les deux sens, entre le corps cellulaire et les extrémités axonales d’un même neurone. On distingue le transport (ou flux) axonal rapide du transport axonal lent.
a) le transport axonal lent : d’une vitesse de 1 à 3 mm par jour, il est exclusivement antérograde et permet le transport de molécules de haut poids moléculaire. Il participe soit au renouvellement du cytoplasme et de la membrane plasmique de l’axone soit à l’élongation des axones observée au cours de la croissance nerveuse ou des processus de régénération axonale.
b) le transport axonal rapide : d’une vitesse de 100 à 400 mm par jour, il est soit antérograde, soit rétrograde.
i) flux antérograde : ce type de transport concerne des molécules de faible poids moléculaire (neurotransmetteurs, protéines membranaires de l’axone) qui sont transportées dans des vésicules cheminant le long des microtubules. Le mouvement de ces vésicules requière une ATPase nommée kinésine.
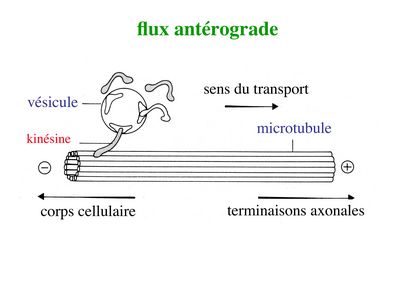
La kinésine va former un pont entre les vésicules et l’extrémité (-) des microtubules puis va générer un mouvement vers l’extrémité (+) des microtubules en hydrolysant l’ATP. Le même mécanisme de transport antérograde s’applique aux mitochondries.
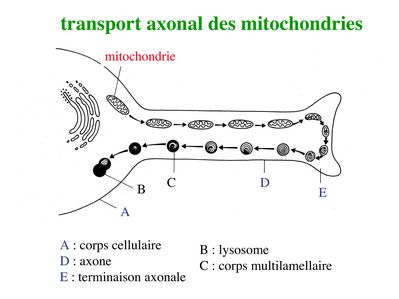
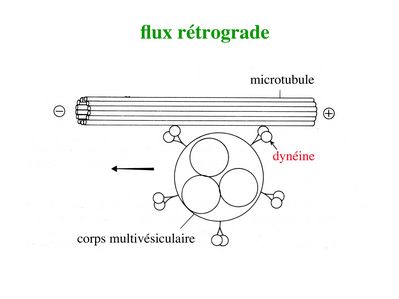
ii) flux rétrograde : ce flux permet le transport vers le soma de deux types de structures observables en microscopie électronique : les corps plurivésiculaires et les corps multilamellaires.
* Les corps plurivésiculaires transportent des molécules membranaires qui soit seront dégradées par les enzymes lysosomales, soit exerceront un effet biologique au niveau du corps cellulaire. C’est le cas par exemple de molécules très importantes pour la survie neuronale, les neurotrophines. Les neurotrophines sont des facteurs solubles indispensables à la survie neuronale ainsi qu'à la pousse axonale au cours du développement. La première neurotrophine identifiée est le NGF (Nerve Growth Factor). Les neurotrophines sont essentiellement synthétisées par les cellules de la névroglie et en particulier par les astrocytes et les cellules de Schwann. Elles sont captées par des récepteurs membranaires spécifiques exprimés au niveau de la membrane axonale et c’est l’ensemble neurotrophine couplée à son récepteur qui est transporté par voie rétrograde jusqu’au corps cellulaire neuronal. Outre les neurotrophines, de nombreuses molécules captées dans le milieu extracellulaire par les terminaisons axonales sont également transportées jusqu'au corps cellulaire. Ces molécules permettent d'informer le neurone sur le milieu extracellulaire. Dans certains cas des molécules toxiques sont captées et transportées jusqu'au corps cellulaire. Ce mécanisme pourrait être en cause dans certaines pathologies neurodégénératives. Par ailleurs, des agents infectieux sont également capables de se disséminer par voie axonale rétrograde. C'est le cas en particulier du virus de la rage (d'ou le temps d'incubation très long) et du prion (agent infectieux non conventionnel impliqué dans la maladie de la vache folle).
* Les corps multilamellaires contiennent des mitochondries dégénérées qui, à l’issue du transport rétrograde, seront dégradées par l’appareil lysosomale des neurones. Des mitochondries nouvellement générées sont parallèlement transportées via le flux axonal antérograde.
Qu'il s'agisse de corps plurivésiculaires ou de corps multilamellaires, le mécanisme du flux axonal rétrograde fait intervenir une ATPase nommée dynéine. La dynéine va former un pont entre d’une part les corps plurivésiculaires ou multilamellaires et d’autre part l’extrémité (+) des microtubules. Puis, en hydrolysant l’ATP, la dynéine va générer un mouvement vers l’extrémité (-) des microtubules, donc vers le corps cellulaire neuronal.
III) Les synapses
1) Définition : le terme général de synapse désigne la connexion permettant la transmission d’informations nerveuses entre deux neurones (synapse interneuronales), entre un neurone et une cellule musculaire striée (synapse neuromusculaire), entre un neurone et une cellule musculaire lisse (synapse autonome) ou entre un neurone et une cellule glandulaire (synapse neuroglandulaire). Chacune de ces catégories de synapses présente des particularités ultrastructurales et fonctionnelles qui lui sont propres. Seules les synapses interneuronales seront envisagées dans ce cours.
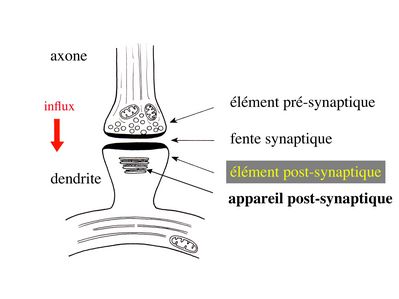
2) Ultrastructure : Les 3 trois éléments ultrastructuraux qui formant une synapse sont l’élément présynaptique ou bouton synaptique, la fente synaptique, et l’élément post-synaptique.
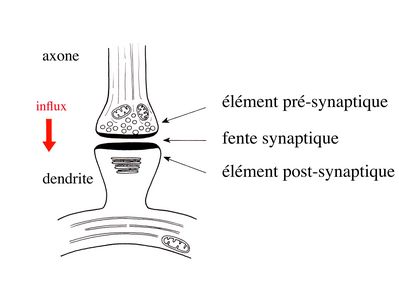
a) l’élément présynaptique : il contient des vésicules de 40 à 60 nm de diamètre, les vésicules synaptiques, qui renferment un neurotransmetteur et des protéines spécifiques nécessaires au fonctionnement des synapses. Parmi ces protéines, citons la chromogranine, protéine impliquée dans l’ « emballage » des neurotransmetteurs, et la synaptophysine qui est une glycoprotéine de la membrane vésiculaire. Les vésicules synaptiques sont groupées sous forme de grappes logées dans des espaces triangulaires contigus. Ces espaces sont délimités par des invaginations de la membrane plasmique, en forme de colonne. Ces invaginations sont reliées par des éléments du cytosquelette. L’ensemble de ces espaces triangulaires constitue le grillage pré-synaptique. Celui-ci peut être comparé à une boîte à œufs dans laquelle s’empile les vésicules synaptiques. En regard de chaque empilement de vésicules, la membrane plasmique est épaissie et présente, à sa face externe (c'est-à-dire sur le versant fente synaptique), de petites dépressions nommées synaptopores.
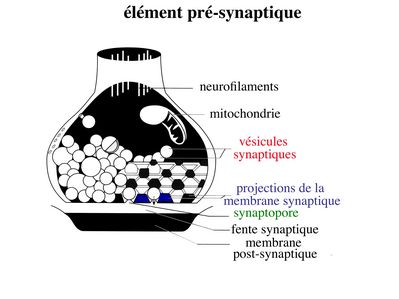
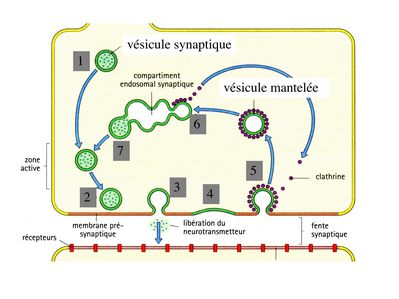
Cette architecture moléculaire sert de support à 2 fonctions essentielles de l’élément pré-synaptique : i) le relarguage des neurotransmetteurs dans la fente synaptique ; ii) le recyclage des vésicules synaptique. Ces 2 fonctions sont couplées et leur réalisation nécessite une série d'évènements consécutifs :
* les vésicules migrent dans la zone dite active qui est la zone d’empilement des vésicules
* les vésicules s'arriment au grillage pré-synaptique
* une onde de dépolarisation atteint le bouton synaptique et déclenche la fusion de la membrane vésiculaire avec la membrane plasmique. Cette fusion correspond à la libération du NT, par mécanisme d'exocytose, dans la fente synaptique.
* la membrane vésiculaire s’intègre à la membrane plasmique
* la membrane vésiculaire est recouverte de molécules de clathrine (molécules impliquées dans le trafic intracellulaire des vésicules quelque soit leur nature). Les molécules de clathrine forment un manteau recouvrant les vésicules et l'on parle alors de vésicules mantelées.
* les vésicules mantelées circulent jusqu’au "compartiment endosomal synaptique", sont débarrassées de leurs molécules de clathrines et fusionnent avec d’autres vésicules d’endocytose. C'est en fait la fusion de vésicules synaptiques en cours de recyclage qui peremt la formation d'un compartiment endosomal synaptique, localisé dans le bouton synaptique.
* une nouvelle vésicule chargée de molécules de neurotransmetteur libre naît par bourgeonnement de ce compartiment endosomal et rejoint la zone active.
b) la fente synaptique : large de 20 nm, elle contient fréquemment un matériel dense aux électrons qui correspond à un épaississement du glycocalyx recouvrant les membranes plasmiques pré- et post-synaptiques. Elle contient également des molécules de neurotransmetteur libres qui iront se fixer à des récepteurs spécifiques au niveau de la membrane post-synaptique. Alternativement ces molécules seront re-captées par des transporteurs spécifiques et recyclées par l’élément pré-synaptique. Enfin un certain nombre de molécules pourront être captées par les astrocytes via des transporteurs spécifiques (cf infra).
c) l’élément post-synaptique : morphologiquement, il est formé par un épaississement de la membrane plasmique. À distance de cet épaississement de la membrane plasmique, on trouvera des structures de morphologie variées, regroupées sous le terme d’appareil post-synaptique. L’appareil post-synaptique localisé au niveau des épines dendritiques est le mieux caractérisé. Il est composé d’un empilement de citernes aplaties.
3) Classification :
a) classification biochimique : dans le système nerveux central, on observe 6 grandes catégories de synapse selon la nature du neurotransmetteur contenu dans les vésicules synaptiques. Par ordre de fréquence décroissant, on distingue :
- les synapses glutamatergiques : excitatrices, elles constituent 50% des synapses du système nerveux central
- les synapses gabaergiques : inhibitrices, elles constituent 30% des synapses du système nerveux central ;
- les synapses cholinergiques : à densité élevée au niveau de l'hippocampe (région du cerveau ou le regroupement des corps cellulaire neuronaux prend la forme d'un hippocampe), elles constituent environ 10% des sysnapses du système nerveux central et sont impliquées dans les fonctions mnésiques (la mémoire)
- les synapses dopaminergiques : nombreuses dans les noyaux gris centraux, elles participent au contrôle du mouvement
- les synapses sérotoninergiques interviennet dans la régulation des états de veille/sommeil et dans la perception de la douleur
- les synapses noradrénergiques sont essentiellement présentes dans le système nerveux périphérique ou elles participent au fonctionnement du système nerveux végétatif. On en trouve toutefois, en faible nombre, dans le système nerveux central.
b) classification fonctionnelle : elle est basée, entre autres, sur l'existence de synapse inhibitrices, ou excitatrices et sur la notion de synapses à fonction spécialisée (cf supra).
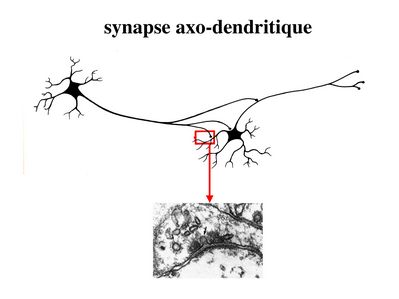
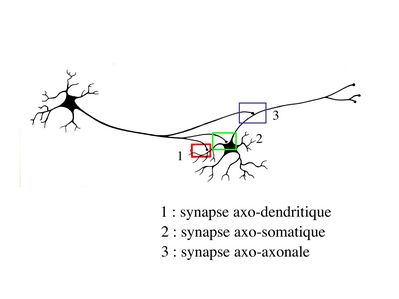
c) classification topographique : elle est basée sur la localisation du contact synaptique. On distingue essentiellement par ordre décroissant de fréquence : i) les synapses axo-dendritiques ; ii) les synapses axo-somatiques ; iii) les synapses axo-axoniques.
4) Fonctions : outre la fonction synaptique principale de neurotransmission, les synapses et l’activité électrique neuronale d’une façon générale exercent un certain nombre de fonctions non conventionnelles. En voici 3 exemples :
a) maintien architectural : l’activité électrique neuronale fournit des informations nécessaires aux oligodendrocytes pour maintenir la structure de la gaine de myéline
b) immunomodulation : l’activité électrique neuronale régule négativement le niveau d’expression des molécules d’histocompatibilité par les cellules gliales environnantes et notamment les cellules microgliales
c) soutien trophique : l’activité électrique neuronale induit la synthèse neuronal d’ARNm codant pour des neurotrophines qui pourront exercer un effet trophique sur le mode autocrine.
![]()