I) Généralités :
1) définition : le tissu musculaire est composé de cellules contractiles, les myocytes, et de matrice extra-cellulaire organisée en lame basale. Il existe 3 types de tissus et de cellules musculaires :
- le tissu musculaire strié qui permet les mouvements volontaires sous contrôle du système nerveux dit cérébro-spinal
- le tissu musculaire lisse qui permet les mouvements non volontaires sous contrôle du système nerveux dit autonome ou végétatif
- le tissu musculaire myocardique qui permet la contraction non volontaire du muscle strié cardiaque sous contrôle du système nerveux autonome.
2) myocyte : Quel que soit leur tissu d'appartenance, les myoytes, c'est-à-dire les cellules musculaires encore appelées fibres musculaires, possèdent les caractéristiques suivantes :
a) le cytoplasme des myocytes contient deux types de protéines filamentaires contractiles nommés myofilaments : des myofilaments d'actine constitué d'isoformes musculaires de l'actine et des myofilaments de myosine.
b) la membrane plasmique contient de nombreux recepteurs et transporteurs, notamment des transporteurs du glucose.
c) une membrane basale recouvre les myocytes.
d) les myofilaments d'actine des myocytes sont ancrés à la laminine de la membrane basale par un complexe protéique transmembranaire constitué entre autres d'une molécule de dystrophine.
II) le tissu musculaire strié squelettique
1) structure générale : les muscles striés squelettiques comprennent 4 composantes que nous allons aborder successivement : musculaire (le tissu musculaire à proprement parler), conjonctive, vasculaire et nerveuse.
a) composante musculaire :
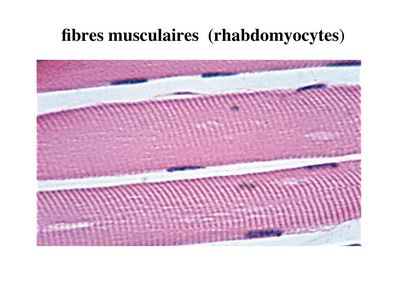
Le corps du muscle strié est relié au squelette par les tendons. Il est formé de faisceaux de fibres musculaire (1 fibre musculaire = 1 cellule musculaire). La cellule musculaire striée, encore appelée rhabdomyocyte, à la forme d'un fuseau d'environ 50 microns de diamètre et pouvant atteindre 50 cm de long. es rhabdomyocytes possèdent plusieurs centaines de noyaux situés en périphérie de la cellule, contre la membrane plasmique encore appelée sarcolemme. Le rhabdomyocyte contient dans son cytoplasme des myofibrilles qui sont formée par l'alignement d'unités contractiles élémentaires nommées sarcomères. Cet alignement confèrent un aspect strié aux rhabdomyocytes.

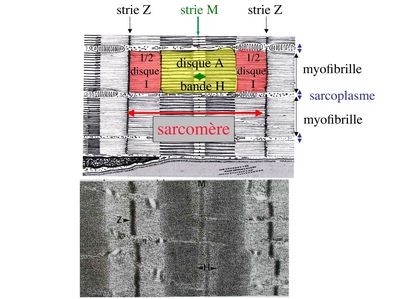
En coupe longitudinale après coloration standard, cette striation est observable en microscopie optique et correspond à l’alternance de bandes sombres et de bandes claires.
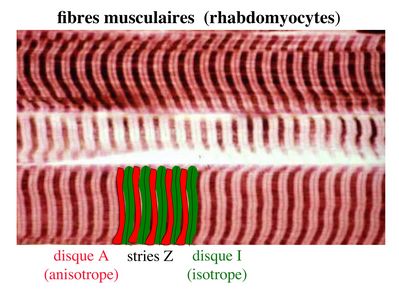
La bande sombre est nommée disque A car elle est anisotrope en microscopie à lumière polarisée c’est-à-dire d’aspect inhomogène. La bande claire est nomméebande I car elle est isotrope c’est-à-dire homogène. Chaque bande claire est traversée d’une ligne transversale qu’on nomme strie Z.
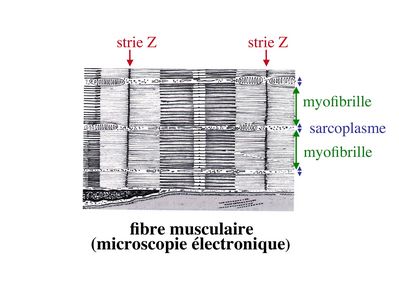
Entre les myofibrilles, le cytoplasme restant est nommé sarcoplasme et contient les organites et molécules suivantes :
- des mitochondries volumineuses alignées en file le long des myofibrilles et qui leur fournissent l'ATP nécessaire à la fonction contractile
- des grains de glycogène permettant le stockage du glucose.
- des molécules de myoglobine qui donnent leur coloration rouge au muscle et dont la fonction est de fixer l’oxygène et de le transmettre au mitochondries.
- des protéines du cytosquelette (filaments intermédiaires de desmine et microtubules) assurant la cohésion des faisceaux de myofibrilles
- d’autres protéines telles que la créatine et la créatine phospho-kinase (CPK), enzme qui permet le catabolisme de la créatine en créatinine (la créatininémie est corrélée à la masse musculaire ; par ailleurs, la clearance de la créatinine est reflet de la fonction rénale)
- des poches de réticulum endoplasmique lisse encore appelé réticulum sarcoplasmique qui forment un réseau participant au système dit sarcotubulaire ou système T.
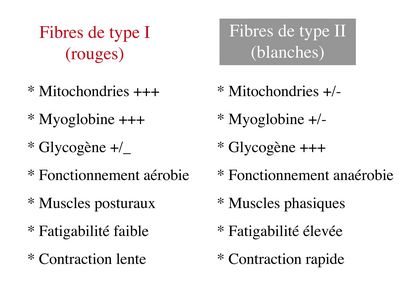
La richesse relative en glycogène, mitochondries et myoglobine permet de distinguer les fibres de type I (dites rouges) des fibres de type II (dites blanches).
Les fibres rouges sont riches en mitochondries et myoglobine mais pauvres en glycogène. Elles ont un fonctionnement aérobie et sont abondantes dans les muscles posturaux (muscles impliqués dans le maintien des postures : muscles abdominaux, muscles intercostaux par exemple). Leur fatigabilité est faible et leur contraction lente.
Les fibres blanches sont riches en glycogène mais pauvres en mitochondries et myoglobine. Elles ont un fonctionnement anaérobie et sont abondantes dans les muscles phasiques (muscles dont l'activité repose sur une alternance de phases contractiles et de phases de repos ; biceps, triceps par exemple). Leur fatigabilité est élevé et leur contraction rapide.
b) composante conjonctive : Les fibres musculaires striées (c'est-à-dire les cellules musculaires) sont groupées en faisceaux et sont réunies et entourées par un tissu conjonctif formant plusieurs tuniques. L'épimysium revêt le muscle dans son entier, lepérimysium entoure chaque faisceau et l'endomysium est le nom donné au tissu conjonctif entourant chaque fibre musculaire.
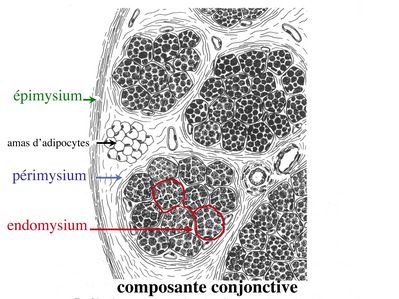
On trouve également des amas d’adipocytes au sein de du périmysium. Par ailleurs, les cellules musculaires et le tissu conjonctif de soutien sont reliés au squelette par les tendons, formations de tissu conjonctif dense dont les fibres de collagène adhérent à l’épimysium mais aussi à la membrane basale des cellules musculaires les plus longues.
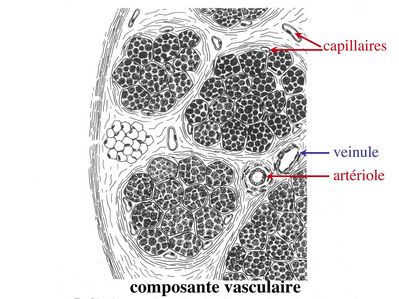
c) composante vasculaire : Des vaisseaux sanguins (artérioles et veinules) circulent dans les cloisons conjonctives du périmysium et forment un réseau capillaire artérioveineux au niveau de l'endomysium. Ce réseau entoure chaque fibre musculaire.
d) composante nerveuse :
Innervation motrice : Chaque cellule musculaire est innervée par une fibre nerveuse motrice issue d'un motoneurone alpha. Le corps cellulaire de chaque motoneurone alpha est localisé dans la corne antérieure de la moelle épinière et envoie un axone dont chacune des terminaisons fait synapse au niveau d'une jonction neuromusculaire, encore appelée plaque motrice. Chaque motoneurone commande ainsi plusieurs fibres musculaires via l'arborisation axonale terminale.
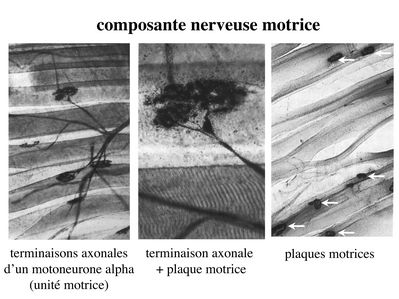
Le neurotransmetteur des jonctions neuromusculaires est l’acétylcholine et les récepteurs de l’acétylcholine sont localisés sur la membrane plasmique des fibres musculaires. Dans la fente synaptique, l’acétylcholine en excès est dégradé par lal’acétylcholine estérase. L'ensemble des fibres musculaires sous contrôle d'un motoneurone constitue une unité motrice.
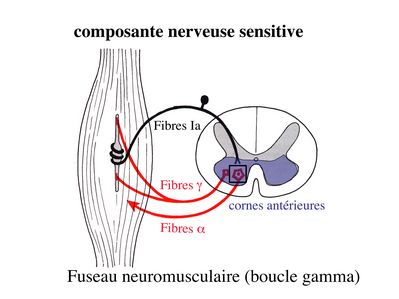
Innervation sensitive : Le muscle strié est également innervé par des fibres nerveuses sensitives qui font synapse au niveau de deux structures équipées de mécanorécepteurs : les fuseaux neuromusculaires et les organes neurotendineux. Les fuseaux neuro-musculaires sont des structures encapsulées localisées au sein de l’endomysium et formées de fibres musculaires spécialisées, les fibres intrafusales, et de fibres sensitives (des fibres 1-a) sensibles à l’étirement des fibres musculaires intrafusales.
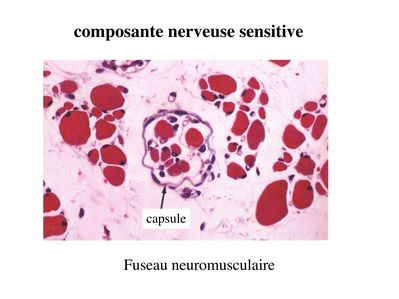
A l’état basal, le maintien d’un état d’étirement normal des fibres intrafusales est assuré par des fibres nerveuses motrices spécialisées, les fibres gamma. Lorsqu’un étirement mécanique du muscle se produit, la stimulation des fibres 1-a entraîne la stimulation des motoneurones alpha de la corne antérieure, stimulation qui est responsable de la contraction des fibres musculaires intra et extrafusales, ce qui permet de stopper l’étirement.
2) le sarcomère :
a) ultrastructure morphologique : Chaque sarcomère localisé entre 2 stries Z est constitué de myofilaments parallèles à son grand axe et qui se répartissent en 2 contingents : les myofilaments épais et les myofilaments fins. Le disque sombre oudisque A contient des myofilaments fins et des myofilaments épais ce qui lui confère son aspect anisotrope. Le disque I ou disque clair ne contient que des myofilaments fins ce qui lui confère son caractère isotrope. Ces myofilaments fins s’arriment aux myofilaments fins des sarcomères voisins au niveau des stries Z. Au sein du disque A, la zone centrale appelée bande ou disque H ne contient que des myofilaments épais dont les extrémités se font vis à vis au niveau de la bande M. Les parties latérales du disque A sont les zones ou les myofilaments fins et épais se chevauchent et établissent des contacts nommés ponts d’union.
b) ultrastructure moléculaire :
* myofilaments fins : ils sont constitués de trois éléments :
- des molécules d’actine polymérisées (c'est-à-dire une forme polymérisée d'actine globulaire) qui s’associent en chapelet
- des molécules de tropomyosine qui s’enroule autour de l’axe formé par les molécules d’actine
- des molécules de troponine qui s’insèrent de manière périodique sous forme d’hétérotrimère sur les molécules d’actine. Les hétérotrimères de troponine sont constitués des 3 sous-unités suivantes : 1) la troponine i (inhibitrice) qui masque au repos le site d’interaction de l’actine avec la myosine ; 2) la troponine C qui est capable de fixer le calcium ; 3) la troponine T qui se lie à la tropomyosine
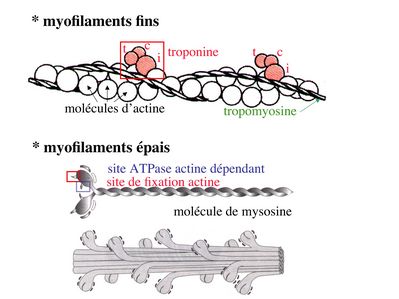
* myofilament épais : chaque myofilament épais résulte de l’assemblage d’environ300 molécules de myosine. La molécule de myosine ressemble à une crosse de Hockey à double tête présentant au niveau de chaque tête 1 site de liaison à l’actine et 1 site à activité ATPase qui est actine dépendante. Les têtes de molécule de myosine émergent régulièrement le long des myofilaments épais selon une disposition hélicoïdale.
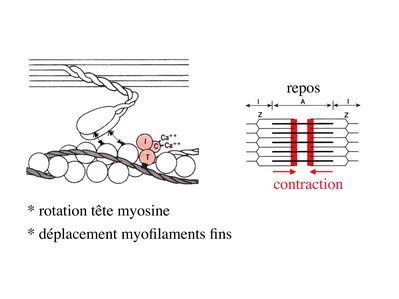
c) fonctionnement :
* au repos : la troponine i masque le site de liaison de la myosine avec l’actine
* l’influx nerveux induit une augmentation de la concentration intracytoplasmique de calcium et celui-ci se fixe à la troponine C. Cette fixation induit un changement de conformation de la troponine qui permet le démasquage du site de fixation de l’actine à la myosine.
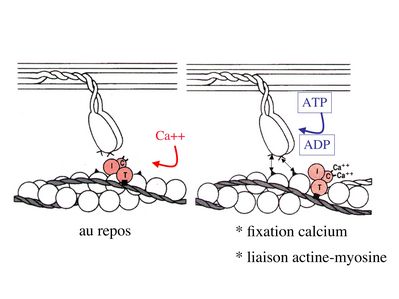
* la liaison actine-myosine déclenche l’activité ATPase de la myosine permettant l’hydrolyse de l’ATP en ADP.
* l’energie fournie permet le basculement de la tête de myosine qui induit un déplacement des myofilament fins le long des myofilaments épais et donc la contraction musculaire.
3) le système sarcotubulaire (ou système T) : La cellule musculaire striée squelettique est un des rares type cellulaire qui est riche en réticulum endoplasmique lisse appelé dans ce cas réticulum sarcoplasmique. Le réticulum sarcoplasmique est constitué par un réseau de canalicules anastomosés qui entoure chaque myofibrille. Ces canalicules se réunissent périodiquement pour former des citernes terminales à chaque jonction entre disque I et disque A. Ces citernes sont le siège de fortes concentrations en calcium (Pour mémoire : dans le muscle lisse, les citernes sont localisées à la jonction entre 2 sarcomères adjacent, au niveau des stries Z). Par ailleurs, au niveau de chaque jonction entre disque I et disque A, on observe entre 2 citernes terminales adjacentes une invagination tubulaire de la membrane plasmique des rhabdomyocytes, le tubule T. Chaque tubule forme ainsi avec 2 citernes terminales adjacentes ce qu’on appelle une triade. C’est l’ensemble des triades que l’on nomme système sarcotubulaire ou système T.
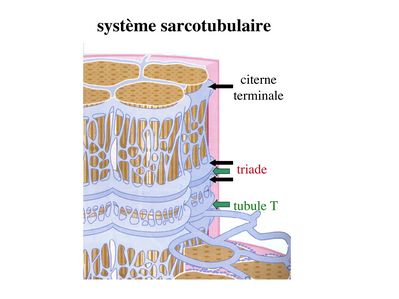
Le rôle du système T est de transmettre l’onde de dépolarisation induite par l’influx nerveux depuis la plaque motrice jusqu’au réticulum sarcoplasmique. Cette onde suit la membrane plasmique jusqu'aux invaginations tubulaires puis est transmise aux citernes terminales. Elle y provoque la libération de calcium en forte concentration et la contraction des myofibrilles.
IV) les cellules satellites : le terme de cellules satellites désigne l’ensemble des cellules localisées dans un dédoublement de la lame basale entourant les des cellules musculaires. Cette population cellulaire est composée de cellules souches musculaireset de progéniteurs myogéniques, les myoblastes, qui permettent la croissance, le renouvellement et la régénérescence du tissu musculaire. Avant d'aborder la morphologie, le phénotype et les fonctions des cellules satellites, nous commencerons par quelques généralités sur les cellules souches.
1) les cellules souches :
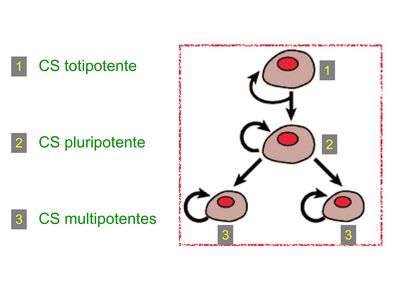
a) définitions : une cellule souche est caractérisée par :
i) des capacités d’autorenouvellement quasi-infinies
ii) un large potentiel de différenciation
iii) un micro-environnement spécifique, la niche des cellules souches.
Les cellules souches embryonnaires totipotentes sont présentes exclusivement dans l'embryon à un stade très précoce (moins de 8 cellules) et sont les seules cellules souches totipotentes c'est-à-dire capables de générer d'une part les cellules du trophoblaste qui donneront ultérieurement le placenta, et d'autre part les cellules de l'ensemble des tissus de l'organisme. Les cellules souches embryonnaires pluripotentes sont présentes dans l’embryon agé de 5 à 7 jours, au niveau de la masse interne. Elles sont capables de générer tous les types cellulaires de l’organisme mais pas les cellules du trophoblaste. Les cellules souches somatiques, encore appelées cellules souches adultes, sont des cellules souches réparties dans l'ensemble des tissus depuis le stade foetal. La grande majorité de ces cellules est multipotente, c'est-à-dire capables de générer un nombre limité de type cellulaires déterminant un lignage cellulaire cellulaire. Les cellules souches somatiques pluripotentes sont d’isolement et de culture très délicate et leur existence même est contestée par certains auteurs. Pour contourner le problème éthique lié à l’utilisation thérapeutique de cellules souches embryonnaires (problèmes des embryons surnuméraires), des chercheurs ont récemment mis au point une technique permettant l’obtention de cellules souches pluripotentes à partir de cellules différenciées adultes (en l’occurrence des fibroblastes). Ces cellules sont nommées cellule souches pluripotentes induites (pour mémoire : la technique utilisée consiste à induire l’expression de facteurs de transcription permettant à la cellule d’acquérir des propriétés de cellules souches pluripotentes).
Les cellules souches sont à distinguer de 2 catégories cellulaires qui ont été initialement inventoriées par les hématologistes :
i) les cellules progénitrices ont un potentiel de différenciation plus restreint que celui des cellules souches dont ils dérivent. Ils ne sont capables que d’un nombre fini de division et ne possèdent pas de capacité d'autorenouvellement. Le terme de « transit amplifying cells » est parfois employé pour désigner des cellules souches dont les capacités d’autorenouvellement sont limitées. Il s’agit d’un stade intermédiaire entre cellules souches et progéniteurs (enlever les exemples)
ii) les précurseurs n’ont pas de capacité d’autrorenouvellement et présentent un potentiel de prolifération et de division restreint (exemple : les monocytes sanguins sont les précurseurs sanguins des macrophages).
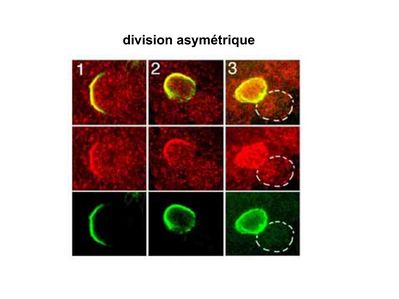
b) fonctions : les cellules souches permettent le renouvellement constant de tous les tissus et, en cas de besoin, assurent la réparation tissulaire. Trois exemples de tissus ou de cellules à renouvellement rapide : les cellules sanguines, l’épithélium intestinal, l’épiderme (chez l’homme on estime ainsi que 100 milliards de GR et de cellules intestinales sont remplacées chaque jour). L'activité des cellules souches est principalement régulée par le microenvironnement qui forme la niche des cellules souches. En particulier, le maintien des cellules souches à l’état quiescent ou leur mise en cycle cellulaire dépend d’un ensemble de signaux délivré par leur micro-environnement. La composition de cette niche est spécifique de chaque type de cellule souche. Premier exemple, les cellules souches hématopoïétiques dans la moelle osseuse rouge sont localisées à proximité d’ostéoblastes et de capillaires sanguins. Deuxième exemple, les cellules souches neurales sont localisées à proximité des cellules épendymaires bordant les cavités ventriculaires. A l’état normal, l'autorenouvellement des cellules souches est réalisé par un mécanisme de division cellulaire qui est propre aux cellules souches : la division asymétrique. Au cours des divisions dites symétriques, 2 cellules filles identiques sont générées, qui sont distinctes de la cellule mère. Au cours des divisions asymétriques, la cellule mère génère une cellule fille et une nouvelle cellule mère identique à la cellule génitrice. Toutefois, en situation de lésion tissulaire nécessitant un surplus de cellules souches, celles-ci s’autorenouvellent par un mécanisme particulier de division symétrique au cours duquel les 2 cellules filles sont identiques à la cellule mère.
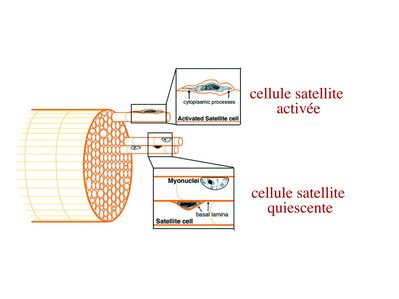
2) morphologie des cellules satellites :
a) les cellules satellites quiescentes : ce sont des cellules souches musculaires. Elles sont localisées dans un dédoublement de la lame basale et sont préférentiellement situées à proximité des capillaires et des plaques motrices. Elles ont un rapport nucléo-cytoplasmique élevé, peu d’organites cellulaires et une hétérochromatine riche (ADN faiblement accessible aux facteurs de transcription). Elles sont dépourvues de ramifications.
b) les cellules satellites activées : ce sont des progéniteurs myogéniques (myoblastes) dérivant des cellules souches satellites. Elles peuvent migrer à distance de leur localisation initiale. Ces cellules présentent une activité mitotique qui s’accompagne de l’enrichissement en organites cellulaires, une diminution du rapport nucléocytoplasmique, l’appauvrissement en hétérochromatine et l’acquisition de ramifications du corps cellulaire.
3) phénotype des cellules satellites : Les cellules satellites quiescentes expriment un certain nombre de marqueurs qui sont présents sur d’autres types de cellules souches et en particulier les cellules souches hématopoïétiques. Il sa'git des molécules de surfaceCD34 et SCA ("stem cell antigen"). Elles expriment également des marqueurs spécifiques du lignage musculaire tels que les facteurs de transcription MNF (myocyte nuclear factor) et la molécule d’adhésion M-cadhérine. L’activation, la prolifération et la différenciation des cellules satellites s’accompagnent de la perte des marqueurs membranaires les plus immatures (CD34, SCA). On observe, en parallèle, l’expression de gènes impliqués dans le phénomène de spécification musculaire. Il s’agit de gènes codant pour des facteurs de transcription contrôlant l’expression d’un ensemble de gènes spécifiques des cellules musculaires matures (pour mémoire : c’est le cas des facteurs de transcription Myf 5 et MyoD).
4) Fonctions des cellules satellites :
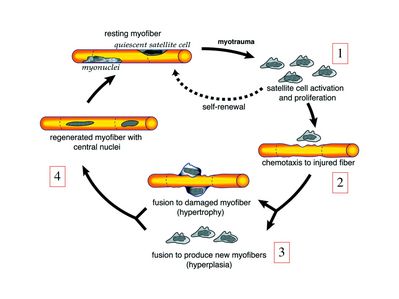
a) mobilisation des cellules satellites : lors de tout traumatisme musculaire (y compris des efforts musculaires répétés conduisant à une hypertrophie musculaire) ou lors de toute perte de fibres musculaires quelle que soit son origine, on observe la séquence suivante :
i) les cellules satellites quiescentes s'activent et prolifèrent. Cette activation/prolifération conduit au renouvellement des cellules satellites quiescentes et à la génération de myoblastes ;
ii) les myoblastes migrent jusqu’au site de lésion en restant sous la lame basale lorsque celle-ci est préservée par le processus pathologique ;
iii) les myoblastes fusionnent avec une fibre musculaire pré-existante (on observe alors une hypertrophie des fibres musculaires) ou fusionnent entre eux pour former une nouvelle fibre musculaire (on observe alors une augmentation du nombre des fibres musculaires : c'est le phénomène d'hyperplasie).
iv) la fibre musculaire nouvellement formée (néo-formée) ou régénérée aura la particularité, pour un temps, de présenter une localisation centrale des noyaux.
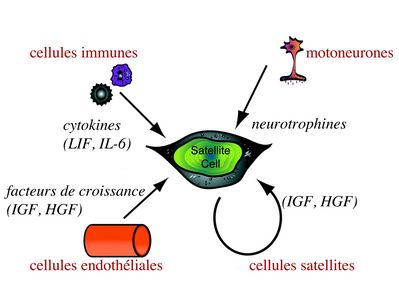
b) contrôle moléculaire : La "mobilisation" des cellules satellites est soumise à une étroite régulation qui dépend de facteurs dérivés essentiellement de 4 types cellulaires :
i) les cellules immunes qui infiltrent le tissu musculaire lésé. On considère qu'un rôle majeur est joué par les macrophages qui synthétisent des cytokines induisant l'entrée en cycle cellulaire des cellules satellites. C'est le cas du LIF ("Leukemia inhibiting Factor") et de l'interleukine-6 ;
ii) les motoneurones contrôlent également la mobilisation des cellules satellites en synthétisant notamment des neurotrophines. Ce rôle des motoneurones donne un sens à la localisation préférentielle des cellules satellites à proximité de la plaque motrice ;
iii) les cellules endothéliales (elles aussi localisées à proximité des cellules satellites) contrôle la mobilisation des cellules satellites via la synthèse de facteurs de croissance (pour mémoire IGF et HGF) ;
iv) les cellules satellites contrôlent leur mobilisation sur un mode autocrine en synthétisant elles aussi des facteurs de croissance.
V) Pathologie du muscle strié squelettique :
1) Myopathies Génétiques :
a) La myopathie de Duchenne : c'est une pathologie à transmission récessive liée au chromosome X, qui touche, à la naissance, un garçon sur 3500 chaque année en France. Cette maladie est liée à la délétion partielle du gène de la dystrophine, qui est le plus long connu de tout notre génome puisqu’il est formé de 2,4 millions de paires de bases. Au plan clinique, on observe une dystrophie musculaire progressive (d’ou le nom donné à la dystrophine) conduisant à la perte de la marche, à une scoliose sévère, puis à des troubles respiratoires et cardiaques.
b) les myopathies métaboliques d’origine génétique : Elles sont dues à des déficits enzymatiques qui perturbent le métabolisme énergétique de la cellule musculaire. On peut les regrouper en deux grandes catégories : les glycogénoses qui touchent les voies de la glycogénolyse, et les cytopathies mitochondriales. Dans le cas des cytopathies mitochondriales, bien que les anomalies mitochondriales soit le plus souvent présentes dans l'ensemble des tissus, les deux tissus qui présentent la souffrance la plus marquée sont le muscle et le cerveau.
2) les myopathies inflammatoires : encore nommées polymyosites, les myopathies inflammatoires sont des pathologies auto-immunes qui surviennent de façon isolée ou associée à d’autres maladies auto-immunes. Dans certains cas, les polymyosites accompagnent de cancers qui n’ont pas encore été détectés. Ils témoignent alors d’un dérèglement du système immunitaire qui accompagne la réponse immune anti-tumorale. Au plan clinique, on observe une faiblesse et des douleurs musculaires parfois accompagnées d’une atteinte inflammatoire de la peau. On parle dans ce cas de dermatomyosite.
![]()