
LE TISSU CARTILAGINEUX
I) le tissu cartilagineux mature :
1) les cellules :
A la différence du tissu osseux mature, il n’y a pas de cellules spécialisées dans la résorption ou la formation de tissu cartilagineux mature. Il s’agit d’un tissu à faible taux de renouvellement au sein duquel on n’observe qu’un seul type de cellules : les chondrocytes.

Les chondrocytes sont des cellules arrondies envoyant de courts prolongements et qui sont entourées de matrice cartilagineuse rigide mais non calcifiée. Cette matrice forme des logettes anatomiques sans parois propres, les chondroplastes. Les chondrocytes interagissent avec la matrice environnante via l’expression membranaire d’Intégrines et de molécules CD44. Les chondrocytes sont des cellules post-mitotiques in vivo mais capables de proliférer in vitro après avoir été prélévés au niveau d’un cartilage mature. En conditions de culture standard, les chondrocytes adhèrent au plastique des boites de cultures et se dé-différencient rapidement en fibroblastes. Pour permettre leur prolifération et le maintien d’un phénotype chondrocytaire, on doit cultiver les chondrocytes dans un gel contenant des facteurs de croissance et des molécules de la matrice cartilagineuse. Les chondrocytes ainsi générés peuvent être utilisés à des fins de recherche ou être réimplantés au sein de cartilages lésés. La greffe autologue de chondrocytes est actuellement utilisée pour le traitement de lésions cartilagineuse du sujet jeune. On a en effet observé que le potentiel chondrogènique des chondrocytes est étroitement dépendant de l’age du donneur (plus faible à partir de 40 ans, très faible à partir de 70 ans). Par ailleurs, on considère que les chondrocytes forment une population hétérogène quant à leur capacité à proliférer in vitro. Au sein d’un tissu cartilagineux articulaire, on observera ces différences fonctionnelles lorsqu’on compare chondrocytes superficiels et chondrocytes profonds. In vivo, les chondrocytes renferment des grains de glycogène et des vacuoles lipidiques dont les fonctions sont encore mal connue. In vivo, les chondrocytes présentent les caractéristiques de cellules à forte activité sécrétrices (idem fibroblastes) : elles sont riches en REG et ont un appareil de golgi développé. Cette activité de synthèse protéique correspond à la sécrétion de cytokines, de facteurs de croissance, et de l’ensemble des protéines de la matrice cartilagineuse. Ils possèdent également tout l'équipement enzymatique et moléculaire nécessaire à la résorption du tissu cartilagineux et notamment des métalloprotéases ("matrix metalloprotéases : MMP"). Toutefois cette fonction s'effectue à très bas bruit dans le tissu cartilagineux adulte normal. Par ailleurs, les chondrocytes expriment de nombreux récepteurs hormonaux tel que le récepteur à l’hormone de croissance (GH), le récepteur à la vitamine D3 et le récepteur aux oestrogènes.
2) la matrice : Chez l'adulte, on distingue 3 types de tissu cartilagineux qui se distinguent essentiellement par la composition de leur matrice.
a) le tissu cartilagineux hyalin : c'est le plus répandu et il est localisé au niveau des cartilages articulaires, des cartilages trachéo-bronchiques ainsi qu'au niveau des cartilages intercostaux. La matrice y contient différents types de collagène mais majoritairement du collagène type II (pour mémoire : le collagène type II représente 80 à 90% du contenu en collagène de la matrice du tissu cartilagineux hyalin). Le collagène type II n’est pas strictement spécifique des tissu cartilagineux mais présent essentiellement dans ces tissus. Il s'organise en microfibrilles et non pas en fibres et en faisceux comme me collagène I du tissu osseux. De ce fait, il n’est pas observable en MO à l'aide des colorations standards permettant la visualisation des faisceaux de collagène (trichrome de Masson, Jaune Safran). Cette caractéristique associée à l’absence de vaisseaux et de nerfs confère un aspect amorphe à la matrice.
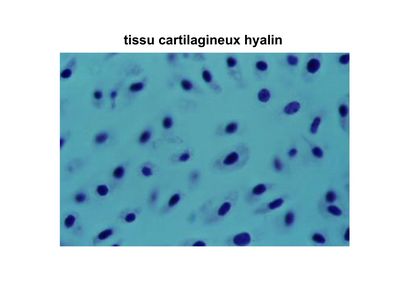
Par ailleurs, le turn-over de ce réseau de collagène est quasiment nul dans le tissu cartilagineux hyalin mature (donc faible capacité de réparation tissulaire). Comme l'ensemble des cartilages, la matrice du tissu cartilagineux hyalin contient essentiellement de l'eau (70 à 80% du poids hydraté). Cette grande capacité de rétention de l'eau est liée à la présence abondante de glycosaminoglycanes (GAG) sulfatés, qui sont riches en radicaux acides hydrophiles. Ces GAG forment des protéoglycanes sulfatés dont le principal est l'aggrécan.
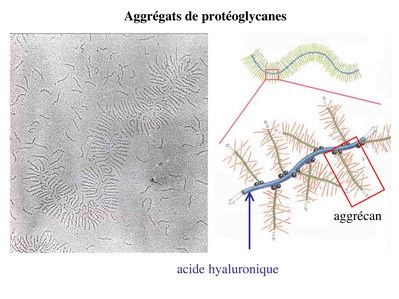
Les molécules d'aggrécan s'assemblent elles-mêmes à des molécules d'acides hyaluronique pour former un maillage d'aggrégats de protéolycanes (Cf cours tissu conjonctif) à forte capacité d'absorption hydrique. Le métabolisme des protéoglycanes au sein du cartilage articulaire dépend des facteurs biomécaniques auxquels est soumise l'articulation. Lors d'une immobilisation complète, on observera une diminution de leur synthèse avec un amincissement cartilagineux associé à une fuite d'eau tissulaire. La fonction de rétention d’eau exercée par les protéoglycanes est responsable la déformabilité et de la résistance du tissu cartilagineux hyalin. Ainsi, lorsqu'une forte pression est exercée sur un cartilage articulaire par exemple, une partie de l'eau est expulsée mais l'augmentation de la pression osmotique induit un afflux d'eau qui rétablit la concentration en eau et une forte pression hydrostatique. Outre la rétention de l'eau, le rôle des protéoglycanes de la matrice cartilagineuse est de permettre la diffusion et/ou la fixation de nombreuses molécules (facteurs de croissance, cytokines, métabolites...) nécessaires à la fonction des chondrocytes. Dans le cas des cartilages articulaires, le tissu cartilagineux est nourri par des molécules diffusant à partir du liquide synovial et du tissu osseux sous-jacent (os sous-chonral). Dans les autres types de cartilages hyalin, ces molécules dérivent d’un tissu conjonctif vascularisé entourant le tissu cartilagineux : le périchondre,
b) le tissu cartilagineux fibreux : encore nommé fibrocartilage, il diffère du cartilage hyalin par la présence abondante de fibres de collagène type I. Ces fibres forment des faisceaux orientés détectables en microscopie optique après coloration au trichrome de Masson.
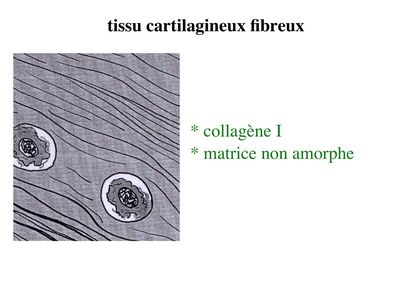
Par conséquent la matrice de ce tissu cartilagineux ne peut être considérée comme amorphe. Le fibrocartilage est présent au niveau du tendon d'Achille, des ménisques et des disques intervertébraux.
c) le cartilage élastique : le cartilage élastique est caractérisé par l'abondance des chondrocytes et par la présence d'un réseau tridimensionnel de fibres élastiques (fibres que l'on peut détecter par une coloration à l'orcéine).
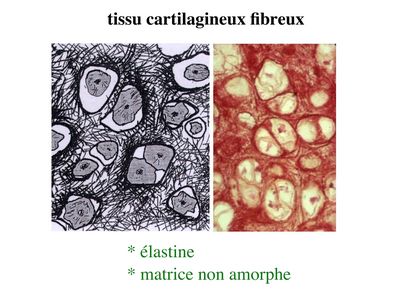
Il est localisé essentiellement au niveau des ailes du nez, des pavillons de l'oreille et de l'épiglotte.
II) le tissu cartilagineux immature : il est observé chez le foetus ou il forme l’ensemble des os long, puis chez l’enfant et l’adolescent ou il participe à la croissance osseuse.
1) les cellules : contrairement au tissu cartilagineux adulte, le tissu cartilagineux immature contient des cellules à riche activité mitotique. Selon le mode de croissance cartilagineuse, il peut s’agir de chondroblastes (précurseurs des chondrocytes) ou de chondrocytes eux-mêmes.
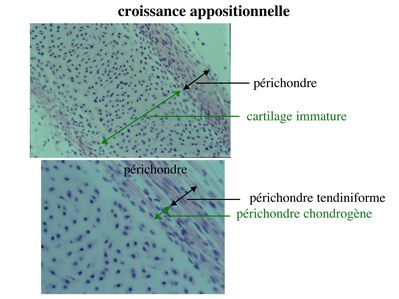
a) la croissance dite appositionnelle (ou périchondrale) : s’opère par prolifération puis différenciation de chondroblastes en chondrocytes. Dans ce cas, les chondroblastes dérivent de cellules souches mésenchymateuses localisées dans la couche la plus interne du périchondre, le périchondre chondrogène. Celui-ci forme un tissu conjonctif lâche (pauvre en fibres et richement vascularisé) qui se distingue de la couche externe du périchondre nommée couche tendiniforme qui est formée de tissu conjonctif dense. La croissance appositionnelle est essentiellement observée au cours du développement fœtal.
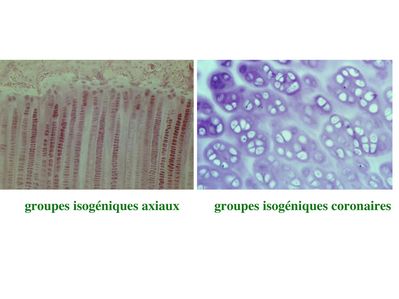
b) la croissance interstitielle : elle s’effectue par mitoses successives des chondrocytes eux-mêmes. Dans ce cas, les cellules filles d’un même clône cellulaire s’éloignent de la cellule mère en se disposant soit de manière rectiligne soit de manière circulaire. Elles forment ce qu’on appelle des groupes isogéniques axiaux ou coronaires. Ces différentes dispositions permettent la croissance axiale ou circonférentielle du cartilage.
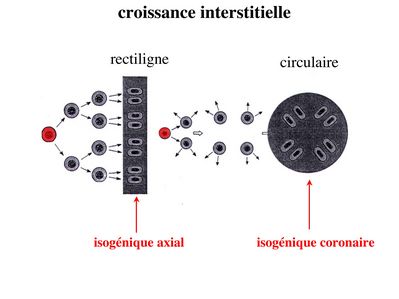
On peut au cours de ce processus observer la présence de plusieurs chondrocytes au sein du même chondroplaste. La croissance interstitielle est observée chez le foetus mais également au cours de la croissance osseuse post-natale des os long. En effet jusqu'à la puberté, la métaphyse des os longs renferme un cartilage de croissance nommé cartilage de conjugaison qui participe à la croissance osseuse.
2) la matrice : La matrice du tissu cartilagineux immature proche de la matrice du cartilage mature hyalin mais présente un certain nombre de spécificités. On retient en particulier la présence non négligeable de collagène IX.
III) Tissu cartilagineux et développement osseux le développement du tissu osseux s'effectue schématiquement en 2 phases qui sont :
i) l'ossification primaire c'est-à-dire la formation initiale du tissu osseux chez le foetus,
ii) l’ossification secondaire c’est-à-dire la croissance et la maturation osseuse qui s'achèvent à la fin de la puberté.
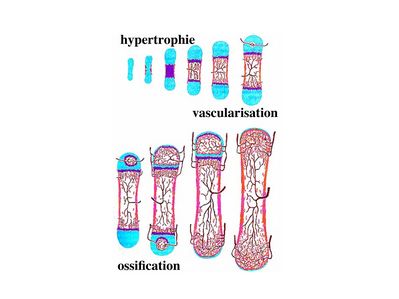
1) tissu cartilagineux et ossification primaire : on désigne sous le terme d'ossification endochondrale la transformation d'un tissu cartilagineux hyalin en tissu osseux. Ce type d’ossification est à distinguer de l’ossification dite endoconjonctive qui consiste en la transformation osseuse d’un tissu conjonctif non spécialisé. Cette ossification endoconjonctive est observée au niveau du périoste qui entoure la diaphyse des os long (on parle d’ossification périostique). Par opposition, dans les os longs, l'ossification primaire endochondrale débute au centre de la diaphyse. La croissance endochondrale débute par un processus d'hypertrophie des chondrocytes. Celui-ci s'accompagne de 3 évènements :
i) l'élargissement des chondroplastes au dépends de la MEC
ii) la synthèse de facteurs angiogéniques dont le VEGF ("vascular endothelial growth factor") induisant la vascularisation locale du tissu cartilagineux
iii) la calcification du tissu cartilagineux (calcification n'équivaut pas à ossification).
Puis, la phase initiale d’hypertrophie des chondrocytes s’achève par leur mort cellulaire programmée (apoptose). Les chondroplastes élargis sont donc vidés de leur contenu et vont devenir confluents. Ils sont alors séparés par des travées de tissu cartilagineux calcifié et vascularisé. Les vaisseaux sanguins pénètrent alors dans les chondroplastes confluents et permettent l'arrivée de cellules souches mésenchymateuses qui vont générer des ostéoblastes. Les ostéoblastes permettent l'ossification des travées de tissu cartilagineux et conduisent à la formation d'un point d'ossification primaire au centre de la diaphyse. Par la suite, on observera de proche en proche le recrutement et la prolifération des chondrocytes entourant le front d’ossification. Dans les os longs, lorsque l'ossification primaire de la diaphyse est suffisamment avancée, débute l'ossification primaire des épiphyses. Il s'agit également d'une ossification endochondrale évoluant de manière centrifuge à partir d'un point d'ossification centro-épiphysaire. Cette ossification préserve une zone de cartilage articulaire en regard de la cavité synoviale et une zone de cartilage immature (le cartilage de conjugaison) au niveau de la métaphyse.
L'ensemble du processus d'ossification primaire ne conduit en fait qu'à l’ossification de travées de tissu cartilagineux : on parle d'os primaire endochondral (os immature, non lamellaire, Cf. cours tissu osseux). Lors d'une deuxième phase qui s'étend jusqu'à la fin de la puberté se déroule l'ossification secondaire c'est-à-dire d'une part le remplacement complet de cet os immature par un os mature dit lamellaire, et d'autre part la croissance en longueur et en épaisseur des os. Enfin, il faut noter que tout phénomène de réparation osseuse, après fracture par exemple, s’accompagne d’une récapitulation des phénomènes caractérisant l’ossification endochondrale. On observe ainsi la formation initiale d’un modèle cartilagineux qui se calcifie et est progressivement remplacé par du tissu osseux.
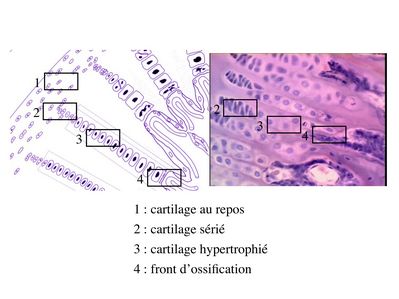
2) tissu cartilagineux et ossification secondaire : la croissance en longueur des os est de type endochondral et fait intervenir les cartilages de conjugaison. Le cartilage de conjugaison est organisé en colonnes et en couches successives qui sont individualisables en microscopie optique. La zone du cartilage hyalin la plus éloignée du front d’ossification constitue une réserve de chondrocytes au repos. Puis on trouve une zone de cartilage sérié ou les chondrocytes prolifèrent et s’aplatissent.
Enfin, à proximité du front d’ossification se trouve une zone dite de cartilage hypertrophié ou les chondrocytes augmentent leur volume par un facteur de 5 à 10. Ces chondrocytes hypertrophiés vont exercer les fonctions suivantes :
i) calcification de la matrice cartilagineuse,
ii) vascularisation du tissu cartilagineux,
iii) recrutement puis différenciation ostéoblastique de cellules souches mésenchymateuses. On considère que ces cellules souches proviennent du tissu conjonctif non spécialisé associé au tissu osseux (endoste, périoste, tissu conjonctif associé à la moelle osseuse rouge).
La croissance en épaisseur des os longs n’est pas de type endochondral et se fait par apposition de couches successives de lamelles osseuses à partir du périoste. Il s'agit d'une croissance endoconjonctive au cours de laquelle on observe la différenciation de cellules souches mésenchymateuses en ostéoblastes, sans intervention d’un autre type cellulaire et san migration par vois sanguine des cellules souches mésenchymateuses.
3) contrôle moléculaire de l'ossification endochondrale :
a) facteurs systémiques : pendant toute la période de croissance post-natale, la croissance en longueur des os longs est sous la dépendance de facteurs hormonaux agissant essentiellement sur les cartilages de conjugaison. Il s’agit principalement de l’IGF1 (dont l’hormone de croissance GH stimule la production par le foie) et des hormones sexuelles i.e. les oestrogènes chez la femme et les androgènes chez l’homme. Ce contrôle hormonal explique la poussée de croissance osseuse au moment de la puberté. Il faut noter que les chondrocytes n’expriment que des récepteurs aux oestrogènes et non aux androgènes. L’effet des androgènes chez le garçon nécessite l’action d’une enzyme intracellulaire qui métabolise les androgènes en oestrogènes. À l’issue de cette période, le stock de chondrocytes contenus dans le cartilage de conjugaison est épuisé, le cartilage de conjugaison est totalement remplacé par du tissu osseux et la taille définitive de l’individu est atteinte.
b) facteurs locaux : les chondrocytes hypertrophiés synthétisent un ensemble de molécules qui permettent : i) soit l’ossification du cartilagineux immature au cours de l’ossification primaire, ii) soit l’ossification des cartilages de croissance au cours de l’ossification secondaire.
i) le VEGF : le « vascular endothelial growth factor » est un puissant agent angiogénique permettant la formation de vaisseaux (on parle de néovascularisation) dans la zone des chondrocytes hypertrophiés. Cette vascularisation est indispensable à la circulation des cellules souches mésenchymateuses vers la zone d’ossification. Par ailleurs, le VEGF exerce une activité chimiotactique (c’est-à-dire une activité d’induction de la migration) sur les ostéoblastes, permettant ainsi de diriger leur migration vers la zone d'ossification.
ii) la molécule Indian Hedgehog (IHH) : il s’agit d’un polypeptide synthétisé par les chondrocytes hypertrophiques ou pré-hypertrophiques. Indian Hedgehog agit sur 3 phases essentielles de l’ossification :
i) la prolifération des chondrocytes,
ii) leur différenciation en chondrocytes hypertrophiés,
iii) la maturation des ostéoblastes.
Il existe une pathologie humaine, nommée brachydactylie, qui est liée à une mutation de l’IHH. Cette pathologie est caractérisée par la longueur anormalement faible des phalanges et des métacarpes.
IV) pathologies du tissu cartilagineux :
1) pathologies mécaniques et dégénératives : elles concernent essentiellement les cartilages articulaires et les fibrocartilages.
a) l’arthrose de hanche (coxarthrose) ou de genou (gonarthrose) : Elle se traduit initialement par l’amincissement du cartilage et une densification réactionnelle de l'os sous-chondral. Puis on observe la disparition complète du cartilage et la survenue de lésions osseuses par frottement. La disparition du cartilage s’accompagne au plan radiologique par la disparition de l’interligne articulaire. La coxarthrose primitive survient le plus souvent entre 50 et 70 ans et est considérée comme d’origine multifactorielle (facteur héréditaires + facteurs aggravants tel que l’obésité et les microtraumatismes). L'arthrose secondaire survient plus précocement chez des sujets aux antécédents de traumatisme, d’anomalies de croissance ou d'anomalies de développement tel que la luxation bilatérale de hanche (pathologie actuellement détectable et traitable à la naissance)
b) lésions des fibrocartilages : l’atteinte dégénérative des fibrocartilages est fréquente au-delà de 50 ans. On peut observer en particulier une dégénérescence des disques intervertébraux responsables d’une atteinte neurologique (sciatique). Au niveau des genoux, une fissuration ou une fracture des ménisques peut être observée. La rupture du tendon d’achille peut également survenir.
2) pathologies inflammatoires : il s’agit principalement de la polyarthrite rhumatoïde qui a pour point de départ l’inflammation du liquide synovial et peut conduire à la destruction du cartilage articulaire. La polyarthrite rhumatoïde est une maladie auto-immune chronique qui touche simultanément plusieurs articulations. Le collagène de type II constitue l’une des cibles antigénique majeure de cette pathologie. Outre l’atteinte du tissu cartilagineux, on observe également une destruction de l’os sous-chondral qui serait lié à une activation dérégulée des ostéoclastes. L’une des avancées thérapeutique majeure des dernières années est l’utilisation d’une molécule inhibitrice du TNF alpha qui bloquerait, entre autres, l’activité accrue des ostéoclastes au niveau de l’os sous-chondral. Dans certains cas, la polyarthrite rhumatoïde peut être associée à des manifestations extra-articulaires et entrer alors dans le cadre plus large des collagénoses (atteinte des tissus contenant du collagène donc essentiellement les tissus conjonctifs).
![]()